Conine
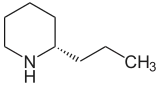
La conine (ou coniine ; conicine ; cicutine), du grec kônion (cigüe), est un alcaloïde, dérivé de la pipéridine, existant en deux stéréoisomères : la (S)-coniine (CAS 458-88-8), l'isomère naturel présent dans la ciguë, et la (R)-conine (CAS 5985-99-9).
| Conine | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 2(S)-Propylpipéridine | |
| Synonymes |
Coniine, conicine, cicutine |
|
| No CAS | ||
| No ECHA | 100.006.621 | |
| No CE | 207-282-6 | |
| PubChem | 441072 | |
| InChI | ||
| Apparence | Liquide brun clair, huileux | |
| Propriétés chimiques | ||
| Formule | C8H17N [Isomères] |
|
| Masse molaire[1] | 127,227 3 ± 0,007 8 g/mol C 75,52 %, H 13,47 %, N 11,01 %, |
|
| pKa | 11[2] | |
| Propriétés physiques | ||
| T° fusion | −2 °C[3] | |
| T° ébullition | 166 °C[3] | |
| Masse volumique | 0,844 à 0,848 g·cm-3 à 20 °C[3] | |
| Pression de vapeur saturante | 23 mbar à 61 °C[3] | |
| Propriétés optiques | ||
| Indice de réfraction | 1,4505 | |
| Pouvoir rotatoire | +15,7 ° | |
| Écotoxicologie | ||
| DL50 | souris: 80 mg·kg-1 (sous-cutané) souris: 100 mg·kg-1 (oral) souris: 19 mg·kg-1 (i.v.) chat: 3 mg·kg-1 (i.v.) |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
La conine est un poison neurotoxique.
Histoire
L'une des premières et plus célèbres victimes connues de la conine est le philosophe Socrate, contraint à se suicider par ingestion d'une solution à base de grande ciguë.
La conine a été isolée la première fois comme une base libre de la Grande Ciguë (Conium maculatum) en 1827 par Giesecke. Son étude fut poursuivie par M. Geiger et M. Ortigosa. Elle fut synthétisée pour la première fois par le chimiste allemand Albert Ladenburg en 1886, par la réaction de condensation de Knoevenagel[4]. C'est le premier alcaloïde à avoir été ainsi synthétisé.
Propriétés
La conine se présente sous la forme d'un liquide brun clair, huileux, à l'odeur proche de l'urine de souris ou de chat, surtout quand on froisse la plante[6]. Elle est relativement peu soluble dans l'eau (10 mL pour un litre d'eau), mais est soluble dans l'éthanol et l'éther[7].
C'est un alcaloïde ganglioplégique (inhibiteur des ganglions sympathiques et parasympathiques) qui provoque une paralysie respiratoire.
 Représentation 3D de la conine
Représentation 3D de la conine Représentation en bâtonnets 3D de la conine
Représentation en bâtonnets 3D de la conine
Occurrence
La conine est naturellement présente dans la grande cigüe, mais aussi dans la petite ciguë et la sarracenia flava. Toutes les parties de ces plantes contiennent de la conine, mais elle est réellement concentrée dans leurs graines.
Synthèse
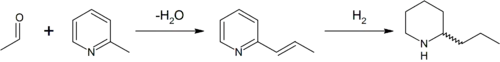
De l'iodure de méthylpyridinium est chauffé à 300 °C pour obtenir de la 2-méthylpyridine. Cette dernière est mise à réagir avec de l'éthanal (acétaldéhyde) en présence de base, pour former la 2-propénylpyridine par condensation de Knoevenagel. Celle-ci subit une hydrogénation catalytique pour former la conine.
Il s'agit de la synthèse historique de Ladenburg.
Biosynthèse
La conine fait partie, avec la n-méthylconine, la conhydrine, la pseudoconhydrine, et la gamma-conicéïne des alcaloïdes du conium, tous présents dans la grande ciguë. Ces dérivés de la pipéridine sont synthétisés par la plante par additions d'unités C2 sur l'acide 3,5,7-trioxooctanoïque, qui est ensuite réduit puis subit une transamination cyclique qui le transforme en γ-conicéïne. À partir de ce produit, la plante peut synthétiser tous les alcaloïdes du conium[8] (une première hypothèse de biosynthèse à partir de la lysine a été rejetée).
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Coniin » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ChemIDplus
- Entrée « Coniine » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 4 avril 2009 (JavaScript nécessaire)
- Hesse, M. : Alkaloide, 2000, Helvetica Chimica Acta, (ISBN 3906390195)
- L. Boucherie, E. Coudray, Guide pratique de chimie, Paris, 1906.
- (en) Dietrich Frohne et Hans Jürgen Pfänder, Poisonous Plants, Timber Press, , p. 47
- Ammon, H. P. T. : Hunnius pharmazeutisches Wörterbuch, 2004, Walter de Gruyter, (ISBN 3110174871)
- Glotter, E., Zechmeister, L. : Fortschritte Der Chemie Organischer Naturstoffe, 1971, Springer Verlag, (ISBN 3211810242)