Chlorure de cérium(III)
Le chlorure de cérium(III) (ou chlorure céreux ou trichlorure de cérium), est un composé chimique de cérium et de chlore, de formule CeCl3. Ce sel blanc hygroscopique, exposé à l'air humide, forme un hydrate de composition variable[1], mais dont la forme heptahydrate CeCl3·7H 2 O est identifiée.
| Chlorure de cérium (III) | |
| Identification | |
|---|---|
| Nom UICPA | chlorure de cérium (III) |
| No CAS |
(heptahydrate) |
| No ECHA | 100.029.298 |
| PubChem | 24636 |
| ChEBI | CHEBI:35458 |
| Apparence | solide blanc |
| Propriétés chimiques | |
| Formule | Ce1Cl3 |
| Masse molaire | 246,48 g/mol (anhydre) 372,58 g/mol (heptahydrate) |
| Susceptibilité magnétique | +2 490,0 × 10−6 cm3/mol |
| Propriétés physiques | |
| T° fusion | 817 °C (anhydre) 90 °C (heptahydrate) |
| T° ébullition | 1,727 °C |
| Solubilité | soluble dans l'eau, l'éthanol et l'acétone |
| Cristallographie | |
| Structure type | hexagonal (type UCl3), hP8 |
| Précautions | |
| SGH | |
   Attention |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Préparation de CeCl3 anhydre
L'hydrate seul s'hydrolyse très facilement dans des conditions de température douces[3].
On peut obtenir du CeCl3 anhydre en chauffant progressivement l'hydrate à 140°C pendant plusieurs heures sous vide[2] - [4] - [5]. À l'issue de cette hydrolyse, il est possible d'obtenir du solide oxydé CeOCl, cependant il est possible de l'isoler par réaction avec les organolithiens et les réactifs de Grignard.
Le solide CeCl3 pur anhydre peut être obtenu par déshydratation de l'hydrate, soit en chauffant lentement à 400 °C avec quatre à six équivalents de chlorure d'ammonium sous vide poussé[3] - [6] - [7] - [8], soit en chauffant avec un excès de chlorure de thionyle pendant trois heures[3] - [9]. L'halogénure anhydre peut être préparé alternativement à partir de cérium métallique ou de chlorure d'hydrogène[10] - [11]. Il est généralement purifié par sublimation à haute température sous vide poussé.
Utilisations
Le chlorure de cérium(III) peut être utilisé pour la préparation d'autres sels de cérium, tels que le trifluorométhanesulfonate de cérium(III), un acide de Lewis, utilisé pour les réactions d'acylations de Friedel-Crafts. Il est également utilisé comme acide de Lewis, en tant que catalyseur, dans les réactions d'alkylation de Friedel-Crafts [12].
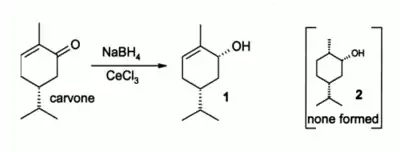
La réduction de Luche[13] des composés carbonylés alpha, bêta-insaturés est une réduction sélective couramment utilisée en synthèse organique, où intervient l'hydrate CeCl3·7H 2 O en présence de borohydrure de sodium. Par exemple, la réduction de la carvone dans ces conditions entraine la formation de l'alcool allylique 1, alors qu'en absence de CeCl3, un mélange de 1 et 2 se forme.
Une autre utilisation importante en synthèse organique concerne l'alkylation des cétones : en substituant les réactifs organolithiens par le chlorure de cérium(III) on évite ainsi la formation d'énolates. Par exemple, on remarque que les conditions réactionnelles ci-dessous entrainent une alkylation douce du composé 3[4].
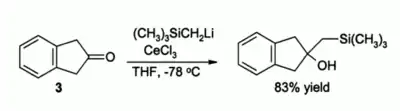
Par ailleurs, les réactifs organolithiens sont plus efficaces dans cette réaction que les réactifs de Grignard[4].
Références
- Several great producers such as Alfa and Strem list their products simply as a "hydrate" with "xH2O" in the formula, but Aldrich sells a heptahydrate[Traduire passage]
- L. A. Paquette, Handbook of Reagents for Organic Synthesis: Reagents, Auxiliaries and Catalysts for C-C Bond Formation, New York, Wiley, (ISBN 0-471-97924-4)
- F. T. Edelmann et Poremba, P., Synthetic Methods of Organometallic and Inorganic Chemistry, vol. VI, Stuttgart, Georg Thieme Verlag, (ISBN 3-13-103021-6)
- Johnson et Tait, B. D., « A cerium(III) modification of the Peterson reaction: methylenation of readily enolizable carbonyl compounds », Journal of Organic Chemistry, vol. 52, no 2, , p. 281–283 (ISSN 0022-3263, DOI 10.1021/jo00378a024)
- Dimitrov, Kostova, Kalina et Genov, Miroslav, « Anhydrous cerium(III) chloride — Effect of the drying process on activity and efficiency », Tetrahedron Letters, vol. 37, no 37, , p. 6787–6790 (DOI 10.1016/S0040-4039(96)01479-7)
- Taylor et Carter, P. C., « Preparation of anhydrous lanthanide halides, especially iodides », Journal of Inorganic and Nuclear Chemistry, vol. 24, no 4, , p. 387–391 (DOI 10.1016/0022-1902(62)80034-7)
- Kutscher et Schneider, A., « Notiz zur Präparation von wasserfreien Lanthaniden-Haloge-niden, Insbesondere von Jodiden », Inorg. Nucl. Chem. Lett., vol. 7, no 9, , p. 815 (DOI 10.1016/0020-1650(71)80253-2)
- N. N. Greenwood et Earnshaw, A., Chemistry of the Elements, New York, Pergamon Press, (ISBN 0-08-022056-8)
- Freeman et Smith, M. L., « The preparation of anhydrous inorganic chlorides by dehydration with thionyl chloride », Journal of Inorganic and Nuclear Chemistry, vol. 7, no 3, , p. 224–227 (DOI 10.1016/0022-1902(58)80073-1)
- Druding et Corbett, J. D., « Lower Oxidation States of the Lanthanides. Neodymium(II) Chloride and Iodide », Journal of the American Chemical Society, vol. 83, no 11, , p. 2462–2467 (ISSN 0002-7863, DOI 10.1021/ja01472a010)
- Corbett, « Reduced Halides of the Rare Earth Elements », Rev. Chim. Minérale, vol. 10, , p. 239
- Mine, Fujiwara, Yuzo et Taniguchi, Hiroshi, « Trichlorolanthanoid (LnCl3)-catalyzed Friedel-Crafts alkylation reactions », Chemistry Letters, vol. 15, no 3, , p. 357–360 (DOI 10.1246/cl.1986.357)
- Luche, Rodriguez-Hahn, Lydia et Crabbé, Pierre, « Reduction of natural enones in the presence of cerium trichloride », Journal of the Chemical Society, Chemical Communications, no 14, , p. 601–602 (DOI 10.1039/C39780000601)
Lectures complémentaires
- CRC Handbook of Chemistry and Physics (58e édition), CRC Press, West Palm Beach, Floride, 1977.
- R. Anwander, Lanthanides: Chemistry and Use in Organic Synthesis, Berlin, Springer-Verlag, , 10–12 (ISBN 9783540645269, lire en ligne)