Cellule d'électrolyse microbienne
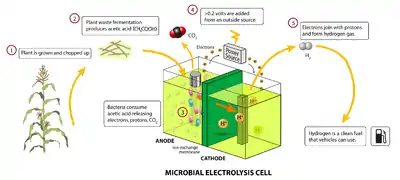
Une cellule d'électrolyse microbienne (CEM ou (en) MEC) est un dispositif technologique apparenté aux piles à combustible microbiennes (MFC). Tandis que ces dernières produisent un courant électrique à partir de la décomposition microbienne de composés organiques, les cellules d'électrolyse microbienne inversent en partie le processus pour générer de l'hydrogène ou du méthane à partir de matière organique en y appliquant un courant électrique[1]. Pour optimiser la soutenabilité du processus, le courant électrique serait produit par une source d'énergie renouvelable. L'hydrogène ou le méthane produit peut être utilisé pour produire de l'électricité au moyen d'une pile à combustible PEM ou d'un moteur à combustion interne supplémentaire.
Éléments constituants
Les systèmes MEC sont composés de :
- Micro-organismes attachés à l'anode : le type des micro-organismes détermine les produits et l'efficacité de la MEC.
- Matières. Le matériau de l'anode d'une cellule d'électrolyse microbienne peut être le même que celui d'un MFC, comme du tissu de carbone, du papier carbone, du feutre de graphite, des granulés de graphite ou des brosses en graphite. Le platine peut être utilisé comme catalyseur pour réduire le surpotentiel nécessaire à la production d'hydrogène. Le coût élevé du platine stimule la recherche sur l'alternative des biocathodes. Des expérimentations on été faites avec des cathodes et des anodes en acier inoxydable[2]. D'autres matériaux comprennent des membranes (bien que certains MEC en soient dépourvus), des tubes et des systèmes de collecte de gaz[3].
Génération d'hydrogène
Les micro-organismes électrogènes alimentés par une source d'énergie telle que l'acide acétique libèrent des électrons et des protons, créant un potentiel électrique pouvant atteindre 0,3 volt. Dans une pile à bactéries conventionnelle, cette tension sert à générer de l'énergie électrique. Dans un MEC, une source électrique extérieure bien dosée fournit une tension supplémentaire à la cellule. Additionnée à la tension d'origine microbienne, elle crée une réaction d'oxydoréduction de protons, produisant de l'hydrogène gazeux. L'énergie électrique totale à la production de dihydrogène (H2) est plus réduite que dans le cas d'une simple électrolyse de l'eau car une partie de l'énergie est fournie par les micro-organismes. La production d'hydrogène a atteint jusqu'à 3,12 m3 de H2 par jour avec une tension d'entrée de 0,8 volt. L'efficacité de la production d'hydrogène dépend des substances organiques utilisées. Les acides lactique et acétique atteignent une efficacité de 82 %, tandis que les valeurs pour la cellulose ou le glucose non prétraités sont proches de 63 %.
L'efficacité de l'électrolyse de l'eau normale est de 60 à 70 %. Lorsque les CEM convertissent la biomasse inutilisable en hydrogène utilisable, ils peuvent produire 144 % d'énergie utilisable en plus qu'ils n'en consomment sous forme d'énergie électrique.Selon les organismes présents à la cathode, les cellules d'électrolyse microbienne peuvent également produire du méthane par un mécanisme connexe.
Calculs
La récupération globale d'hydrogène a été calculée comme suit : RH2 = CERCat. Le rendement coulombien est CE = (nCE/nth), où nth donne les moles d'hydrogène qui pourraient être théoriquement produites et nCE = CP/(2F) représente les moles d'hydrogène qui pourraient être produites à partir du courant mesuré, CP est le total des coulombs calculé en intégrant le facteur d'un durée de production, F est la constante de Faraday et 2 est le nombre de moles d'électrons par mole d'hydrogène. La récupération cathodique de l'hydrogène a été calculée comme RCat = nH2/nCE, où nH2 est le nombre total de moles d'hydrogène produit. Le rendement en hydrogène (YH2) a été calculé par la formule YH2 = nH2/ns, où ns est l'élimination du substrat, calculée sur la base de la demande chimique en oxygène[4].
Usages
L'hydrogène et le méthane peuvent tous deux être utilisés comme carburants alternatifs en remplacement des combustibles fossiles dans les moteurs à combustion interne ou pour la production d'électricité. Comme les piles à combustible microbiennes ou les usines de production de bioéthanol, les cellules d'électrolyse microbienne ont le potentiel de transformer les déchets organiques en une source précieuse d'énergie[5]. L'hydrogène peut également être combiné avec l'azote de l'air pour produire de l'ammoniac, lui-même utilisé pour fabriquer des engrais à base d'ammonium. L'ammoniac a de plus été proposé comme alternative pratique aux combustibles fossiles pour les moteurs à combustion interne[6].
Voir également
Références
- (en) Badwal, « Emerging electrochemical energy conversion and storage technologies », Frontiers in Chemistry, vol. 2, , p. 79 (PMID 25309898, PMCID 4174133, DOI 10.3389/fchem.2014.00079, Bibcode 2014FrCh....2...79B).
- (en) Azwar, Hussain et Abdul-Wahab, « Development of biohydrogen production by photobiological, fermentation and electrochemical processes: A review », Renewable and Sustainable Energy Reviews, vol. 31, no Supplement C, , p. 158–173 (DOI 10.1016/j.rser.2013.11.022)
- (en) Media, « Green Car Congress: Study Concludes That Microbial Electrolysis Cells Are a Promising Approach to Renewable and Sustainable Hydrogen Production », www.greencarcongress.com.
- (en) Shaoan Cheng et Bruce E. Logan, « Sustainable and efficient biohydrogen production via electrohydrogenesis », Proceedings of the National Academy of Sciences of the United States of America, vol. 104, no 47, , p. 18871–18873 (PMID 18000052, PMCID 2141869, DOI 10.1073/pnas.0706379104, Bibcode 2007PNAS..10418871C).
- (en) M. Y. Azwar, M. A. Hussain et A. K. Abdul-Wahab, « Development of biohydrogen production by photobiological, fermentation and electrochemical processes: A review », Renewable and Sustainable Energy Reviews, vol. 31, , p. 158–173 (ISSN 1364-0321, DOI 10.1016/j.rser.2013.11.022, résumé)
- (en) « Penn State Live » [archive du ] (consulté le )