Candida auris
Le Candida auris est une espèce de levures saccharomycetes, identifiée pour la première fois en 2009 à partir d’une souche isolée de l’oreille externe chez une patiente japonaise[1] - [2]. Le Candida auris peut être responsable de candidose, qui est souvent acquis dans les hôpitaux par les patients immunodéprimés. Parfois qualifié de « super-champignon »[3], il est capable de provoquer une candidose invasive et grave en infectant la circulation sanguine, le système nerveux central et divers organes internes. Il est considéré comme un pathogène émergent car une nette augmentation du nombre d’infections du C. auris dans une dizaine de pays de cinq continents a été observée au cours des années 2010. Curieusement, bien que présentant une certaine diversité génétique (entre souches différentes), il semblait « sorti de nulle part » et il a été signalé au même moment sur trois continents différents[4], se répandant rapidement dans une trentaine de pays, dans des hôpitaux et maisons de retraite. Son succès épidémiologique pourrait être lié au réchauffement climatique[3].
| Règne | Fungi |
|---|---|
| Division | Ascomycota |
| Sous-division | Saccharomycotina |
| Classe | Saccharomycetes |
| Sous-classe | Saccharomycetidae |
| Ordre | Saccharomycetales |
| Genre | Candida |
Son traitement est compliqué car il est difficile à identifier et aisément confondu avec d'autres espèces proches comme Candida haemulonii, Candida famata. De plus, le C. auris est souvent multi-résistant aux antifongiques communs. En 2022, l'OMS le classe dans le groupe « priorité critique » de sa liste des champignons à surveiller en priorité[5] - [6].
Identification et morphologie
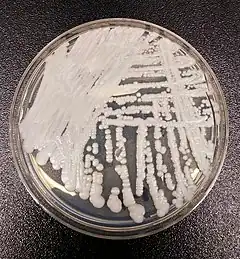
Le Candida auris est une espèce de champignons ascomycètes du genre Candida, qui se développe sous forme de levure, décrite pour la première fois en 2009[2]. Son nom vient du mot latin pour oreille, auris[7]. Il forme des colonies lisses, brillantes, gris blanchâtre et visqueuses sur le support de croissance. Au microscope, les cellules ont une forme ellipsoïdale[2].
Signification clinique
Le Candida auris est l'une des rares espèces de Candida pouvant provoquer une candidose chez l'Homme. La candidose est souvent contractée dans les hôpitaux (maladie nosocomiale) par des patients dont le système immunitaire est affaibli. Elle peut provoquer une candidose invasive, caractérisée par une invasion du flux sanguin (fongémie), du système nerveux central, des reins, du foie, des os, des muscles, des articulations, de la rate ou des yeux.
Le C. auris a attiré de plus en plus d'attention des cliniciens en raison de sa large antibiorésistance (multirésistance aux médicaments)[8] - [9].
Un bref aperçu de sa pertinence clinique à compter de 2016, compréhensible par le grand public, a été publié par le Center for Infectious Disease Research and Policy de l'Université du Minnesota[4].
Traitement
Il est compliqué par le fait que le C. auris résiste déjà à de nombreux antifongiques et antibiotiques, et qu'il est facilement confondu avec d'autres espèces de Candida[8] - [9].
Génome
Plusieurs projets de génomes issus du séquençage du génome entier ont été publiés[8] - [10]. Le génome du C. auris s'est avéré coder plusieurs gènes de la famille des transporteurs ABC (ATP-Binding Cassette) et MFS (major facilitator superfamily), ce qui aide à expliquer sa multirésistance aux médicaments[8]. Son génome code également des familles de gènes liés à la virulence, telles que les lipases, les transporteurs d'oligopeptides, les mannosyl transférases et les facteurs de transcription qui facilitent la colonisation, l'invasion et l'acquisition du fer[8]. Un autre facteur contribuant à la résistance antifongique est la présence d'un ensemble de gènes connus pour être impliqués dans la formation de biofilm[8].
D'autres études sont nécessaires pour déterminer si la divergence phylogénétique des clones de C. auris présente des profils d'invasivité, de virulence et/ou de résistance aux médicaments spécifiques à la région[11].
Épidémiologie
La phylogénie du C. auris suggère l'existence de génotypes distincts dans différentes régions géographiques présentant une diversité génomique substantielle[11]. Une variété de méthodes analytiques basées sur les séquences ont été utilisées pour appuyer cette découverte.
Le séquençage du génome entier et les analyses d’isolats provenant du Pakistan, d’Inde, d’Afrique du Sud, du Venezuela, du Japon et de génomes du C. auris précédemment séquencés et déposés dans les archives de séquence de lecture du Centre national de biotechnologie[12] ont mis en évidence une répartition géographique distincte des génotypes[4]. Quatre clades distincts séparés par des dizaines de milliers de polymorphismes mononucléotidiques ont été identifiés. La distribution de ces clades a été isolée géographiquement en Asie du Sud (Inde et Pakistan), en Afrique du Sud, au Venezuela et au Japon, avec une diversité génétique minimale observée au sein de la région intrarégionale[4].
L'analyse du polymorphisme de la longueur des fragments amplifiés d'isolats du C. auris du Royaume-Uni, d'Inde, du Japon, d'Afrique du Sud, de Corée du Sud et du Venezuela a suggéré que les isolats de Londres formaient un groupe distinct comparé aux autres[13].
Une comparaison des séquences d'ADN ribosomal d'isolats du C. auris d'Israël, d'Asie, d'Afrique du Sud et du Koweït a révélé que les souches d'Israël étaient distinctes sur le plan phylogénétique de celles d'autres régions[14]. Chatterjee et al. a écrit en 2015 : « Sa répartition mondiale réelle reste obscure car les méthodes commerciales actuelles de diagnostic clinique l'identifient à tort comme étant C. haemulonii »[8].
Notes et références
- V. Robert, G. Stegehuis and J. Stalpers. 2005. The MycoBank engine and related databases. https://www.mycobank.org/, consulté le 27 février 2019
- K. Satoh et al., « Candida auris sp. nov., a novel ascomycetous yeast isolated from the external ear canal of an inpatient in a Japanese hospital », Microbiol Immunol, vol. 53, n. 1, 2009, p. 41–44
- Juanita Bawagan (2019) [The rise of a deadly superfungus may be tied to global warming] ; 25 juillet 2019
- Lockhart et al. (2017) Simultaneous Emergence of Multidrug-Resistant Candida auris on 3 Continents Confirmed by Whole-Genome Sequencing and Epidemiological Analyses. Clinical Infectious Diseases. 64(2):134-140
- (en) WHO fungal priority pathogens list to guide research, development and public health action, Organisation mondiale de la santé, , 48 p. (ISBN 978-92-4-006024-1, lire en ligne), p. 10.
- Salomé Kourdouli et Apolline Le Romanser, « «Candida auris», super champignon multirésistant », Libération, , p. 8 (lire en ligne
 )
) - "Candida auris Questions and Answers". Centers for Disease Control. 4 novembre 2016. archivé de l'original le 2 janvier 2017. Consulté le 1er janvier 2017
- Chatterjee, S; et al. (2015), "Draft genome of a commonly misdiagnosed multidrug resistant pathogen Candida auris", BMC Genomics, volume 16, page 686, doi:10.1186/s12864-015-1863-z
- Candida auris Interim Recommendations for Healthcare Facilities and Laboratories". www.cdc.gov. Retrieved 2017-04-01
- Sharma, C; et al. (2015), "Draft genome sequence of a fluconazole-resistant Candida auris strain from a candidemia patient in India", Genome Announc, 3 (4): e00722–15, doi:10.1128/genomeA.00722-15, PMC 4505117,
- Ben-Ami, R; Berman, J; Novikov, A (2017). "Multidrug-Resistant Candida haemulonii and C. auris, Tel Aviv, Israel". Emerging Infectious Diseases. 23 (1): 195–203. doi:10.3201/eid2302.161486. PMC 5324804. .
- National Center for Biotechnology Information’s Sequence Read Archive U.S. National Library of Medicine, retrieved 31 May 2017
- (en) Silke Schelenz, Ferry Hagen, Johanna L Rhodes, Alireza Abdolrasouli, Anuradha Chowdhary, Anne Hall, Lisa Ryan, Joanne Shackleton, Richard Trimlett, Jacques F Meis, Darius Armstrong-James et Matthew Fisher, « First hospital outbreak of the globally emerging Candida auris in a European hospital », Antimicrobial resistance and infection control, BMC et Springer Science+Business Media, vol. 5, , p. 35 (ISSN 2047-2994, PMID 27777756, PMCID 5069812, DOI 10.1186/S13756-016-0132-5).
- R. Miller, 1er avril 1966, « Hospital design », Hospitals, vol. 40, n. 7, p. 91–94, Modèle:Issn, .
Liens externes
- Ressources relatives au vivant :
- Global Biodiversity Information Facility
- (mul + en) iNaturalist
- (en) Index Fungorum
- (en) MycoBank
- Ressources relatives à la santé :
- (en) Medical Subject Headings
- (cs + sk) WikiSkripta