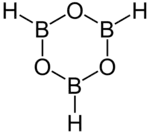
Boroxine
La boroxine, ou cyclotriboroxane, est un composé chimique hétérocyclique de formule H3O3B3 dont le cycle est constitué alternativement de trois atomes d'oxygène et trois atomes de bore, ces derniers étant chacun liés à un atome d'hydrogène. Les anhydrides boroniques comme la triméthylboroxine (de) et la triphénylboroxine (de) forment une classe de composés appelés boroxines. À température ambiante, ce sont des solides généralement en équilibre avec leurs acides boroniques respectifs[2]. La boroxine est un composé très réactif, qui réagit violemment en présence d'oxygène O2 ou de monoxyde de carbone CO, même à température ambiante[3]. Outre son intérêt dans les études théoriques, la boroxine est par exemple utilisée pour réaliser des électrolytes dans les accumulateurs lithium-polymère et surtout pour réaliser des matériaux optiques[4].
Structure et liaison
Le cycle de la boroxine est plan. La molécule est isoélectronique au benzène C6H6 et présente un caractère partiellement aromatique dû à un système π issu des orbitales p vacantes sur les atomes de bore[5]. Les liaisons simples sur le bore dans les composés de boroxine sont essentiellement de type s.
Les substituants ont peu d'effet sur les dimensions du cycle : ainsi, les liaisons B–O de la triéthylboroxine ont une longueur de 138,4 pm et les liaisons B–C ont une longueur de 156,5 pm tandis que ces liaisons ont une longueur respectivement de 138,6 pm et 154,6 pm dans la triphénylboroxine[5] ; ils déterminent en revanche la structure cristalline du solide
Les boroxines substituées avec des groupes alkyle présentent les structures cristallines les plus simples. Ces molécules s'empilent les unes sur les autres en alignant les atomes d'oxygène d'une molécule avec les atomes de bore des molécules adjacentes, de sorte que les cycles ainsi juxtaposés forment un tube. Les distances B–O intermoléculaires des boroxines substituées avec des groupes éthyle sont de l'ordre de 346,2 pm, ce qui est très supérieur à la longueur de la liaison B–O intramoléculaire du cycle, qui vaut dans ce cas 138,4 pm.
La structure cristalline des boroxines substituées avec des groupes phényle est plus complexe. Le cycle boroxine d'une molécule s'empile entre des cycles phényle de molécules adjacentes, ce qui permet aux groupes phényle de céder des électrons π aux orbitales p vacantes des atomes de bore du cycle boroxine[5].
Synthèse et réactions
Les boroxines sont produites par déshydratation de leur acide boronique correspondant[2]. Cette déshydratation peut être obtenue à l'aide d'un agent dessicant ou par chauffage sous vide. Plus récemment, on a pu produire de la triméthylboroxine (de) (H3CBO)3 par réaction de monoxyde de carbone CO avec du diborane B2H6 et du borohydrure de lithium LiBH4 comme catalyseur :
La triméthylboroxine est l'une des boroxines les plus utilisées, notamment pour réaliser des méthylations d'halogénures d'aryle par réactions de Suzuki avec catalyseur à base de palladium[6].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Stephen A. Westcott, « BO Chemistry Comes Full Circle », Angewandte Chemie, vol. 49, no 48, , p. 9045-9046 (PMID 20878818, DOI 10.1002/anie.201003379, lire en ligne)
- (en) George H. Lee II et Richard F. Porter, « Gaseous Boroxine: Mechanisms of Reactions with Oxygen and Carbon Monoxide », Inorganic Chemistry, vol. 5, no 8, , p. 1329-1333 (DOI 10.1021/ic50042a007, lire en ligne)
- (en) Q. G. Wu, Gang Wu, Lorenzo Brancaleon et Suning Wang, « B3O3Ph3(7-azaindole): Structure, Luminescence, and Fluxionality », Organometallics, vol. 18, no 13, , p. 2553-2556 (DOI 10.1021/om990053t, lire en ligne)
- (en) Monika C. Haberecht, Michael Bolte, Matthias Wagner et Hans-Wolfram Lerner, « A new polymorph of tri(p-tolyl)boroxine », Journal of Chemical Crystallography, vol. 35, no 9, , p. 657-665 (DOI 10.1007/s10870-005-3325-y, lire en ligne)
- (en) Matthew Gray, Ian P. Andrews, David F. Hook, John Kitteringham et Martyn Voyle, « Practical methylation of aryl halides by Suzuki–Miyaura coupling », Tetrahedron Letters, vol. 41, no 32, , p. 6237-6240 (DOI 10.1016/S0040-4039(00)01038-8, lire en ligne)