Bilastine
La bilastine (DCI)[2] est une molécule aux propriétés antihistaminiques H1[3]. La bilastine exerce un effet antagoniste sélectif sur les récepteurs H1 périphériques, et est dénuée d'affinité pour les récepteurs muscariniques. Elle est utilisée par voie orale en dose unique dans le traitement des symptômes de l'allergie tels que la rhinite allergique, la rhino-conjonctivite ou l'urticaire. La bilastine est moins sédative que la cétirizine[4]. La tolérance et l'efficacité n'ont pas encore été établies chez les enfants de moins de 12 ans[5].
| Bilastine | |
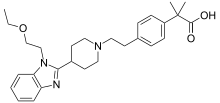
| |
| Structure chimique de la bilastine | |
| Identification | |
|---|---|
| Nom UICPA | acide 2-[4-[2-[4-[1-(2-éthoxyéthyl)-1H-benzimidazol-2-yl]pipéridin-1-yl]éthyl]phényl]-2-méthylpropanoïque |
| No CAS | |
| No ECHA | 100.260.016 |
| Code ATC | |
| PubChem | 185460 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C28H37N3O3 [Isomères] |
| Masse molaire[1] | 463,611 7 ± 0,026 5 g/mol C 72,54 %, H 8,04 %, N 9,06 %, O 10,35 %, |
| Données pharmacocinétiques | |
| Liaison protéique | 84-94 % |
| Métabolisme | la bilastine n'est pas significativement métabolisée chez l'homme (95 % de la dose retrouvée sous forme inchangée) |
| Demi-vie d’élim. | 14,5 heures |
| Stockage | il n'a pas été observé d'accumulation |
| Considérations thérapeutiques | |
| Classe thérapeutique | Antihistaminique H1 |
| Voie d’administration | orale |
| Grossesse | Par mesure de précaution, il est recommandé de ne pas utiliser la bilastine pendant la grossesse. |
| Conduite automobile | Avec des doses allant jusqu'à 40mg/jour, il n'a pas été mis en évidence d'altération des facultés psychomotrices, ni d'effet sur l'aptitude à la conduite des véhicules au cours des essais cliniques. |
| Unités du SI et CNTP, sauf indication contraire. | |
Développement
La bilastine a été développée en tant que médicament par le laboratoire pharmaceutique espagnol Faes sous la référence F-96221-BM1. Elle bénéficie d'une autorisation de mise sur le marché (AMM) en France depuis au dosage de 20 mg[6]. Elle est commercialisée en France par les Laboratoires Pierre Fabre sous le nom de marque INORIAL et par les laboratoires Menarini sous le nom de marque BILASKA.
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Proposed INN list 82 », WHO Drug Information, vol. 13, no 4, , p. 267 (lire en ligne) (en)
- (en) Corcóstegui R, Labeaga L, Innerárity A, Berisa A, Orjales A., « In vivo pharmacological characterisation of bilastine, a potent and selective histamine H1 receptor antagonist », Drugs R D, vol. 7, no 4, , p. 219-31 (PMID 16784247) (en)
- Erminia Ridolo, Marcello Montagni, Laura Bonzano et Cristoforo Incorvaia, « Bilastine: new insight into antihistamine treatment », Clinical and Molecular Allergy : CMA, vol. 13, no 1, (ISSN 1476-7961, PMID 25878559, PMCID PMC4397738, DOI 10.1186/s12948-015-0008-x, lire en ligne, consulté le )
- « Résumé des caractéristiques du produit - BILASKA 20 mg, comprimé - Base de données publique des médicaments », sur base-donnees-publique.medicaments.gouv.fr (consulté le )
- AFSSAPS http://afssaps-prd.afssaps.fr/php/ecodex/frames.php?specid=63858119&typedoc=R&ref=R0188969.htm