Aurone (groupe)
Les aurones sont une classe restreinte de flavonoïdes (quelques dizaines d'aurones naturelles sur près de 4000 flavonoïdes) présente naturellement dans certaines fleurs, comme le Muflier, le Dahlia ou le Coréopsis, et qui leur confère leur couleur jaune d'or[1]. Isomères structuraux des flavones, les aurones peuvent présenter des propriétés biologiques diverses d'antioxydants, d'anticancéreux ou d'antiparasitaires.
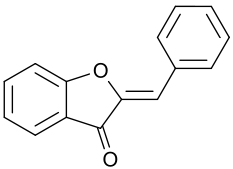

Structure
Les aurones ont une structure proche mais différente de la plupart des autres flavonoïdes. En effet, même si ces molécules dérivent aussi de la chalcone (qui se ferme pour former un second cycle), dans les cas des aurones, la chalcone se ferme en formant un cycle à 5 atomes, alors qu'elle forme un cycle de 6 atomes pour les autres flavonoïdes.
Rôle biologique
Les flavonoïdes sont en grande partie responsables de la coloration naturelle des fleurs. Comme pour de nombreux composés naturels, l’intérêt pharmacologique des flavonoïdes a très vite été démontré et ces molécules sont aujourd’hui considérées comme des agents pharmacologiques de premier ordre, par le nombre et la diversité de leurs activités biologiques. Parmi ceux-ci, les aurones occupent une place restreinte, la première aurone ayant été découverte seulement en 1943[2]. Elles sont notamment impliquées dans la coloration jaune intense de plusieurs espèces de fleurs comme Antirrhinum majus (Muflier), Coreopsis maritima (Coreopsis) ou Dahlia variabilis (Dahlia). Leur présence dans un organisme marin a en outre été rapportée récemment[3].
Synthèses
Biosynthèse
Dans la nature, les aurones sont synthétisées comme les autres flavonoïdes par fermeture et formation d'un second cycle de la chalcone.
Synthèses chimiques
Le mécanisme biochimique de formation des aurones a inspiré les chimistes, qui ont tenté de l’adapter à leur synthèse chimique. Ainsi, une méthode de cyclisation oxydante de chalcones a été mise au point dans les années 1970, mais l’utilisation d’acétate de mercure a rapidement posé des problèmes de toxicité. Cushman et al. ont décrit l’utilisation de trinitrate de thallium pour le même type de réaction, mais la présence nécessaire d’un groupement électrodonneur en position 5’ de la chalcone et l’introduction d’un groupement alkoxyle en position 4 de l’aurone lors de la réaction constituent des contraintes importantes. Enfin, une méthode plus récente permet, avec l’utilisation de tribromure de tétrabutylammonium puis de potasse dans l’éthanol, de réaliser la cyclisation de la chalcone après bromation de la double liaison au pied du carbonyle. Cette voie se révèle efficace avec un large spectre de chalcones substituées et mène donc à la synthèse d’une importante diversité d’aurones avec de bons rendements.
La synthèse à partir de dérivés du benzofuran-3(2H)-one constitue également une méthode de choix pour obtenir certaines aurones. L’intermédiaire-clef est obtenu par une acylation de Friedel-Crafts avec le chloroacétonitrile sur un dérivé de phénol, suivie d’une hydrolyse et d’une cyclisation en milieu basique. Une condensation en milieu acide ou basique avec un aldéhyde aromatique mène ensuite à l’aurone correspondante. Cette dernière étape peut être menée dans des conditions éco-compatibles, notamment grâce à l’apport des micro-ondes, de la chimie sans solvants et du support solide.
Très récemment, une nouvelle méthode de synthèse a été mise au point. Elle commence par l’alcynylation d’un aldéhyde aromatique par un alcyne aromatique, puis une cyclisation est réalisée, catalysée par un complexe d’or(I). Enfin, une oxydation de l’alcool allylique obtenu permet de produire l’aurone correspondante.
Il est important de noter que toutes les méthodes de synthèse décrites précédemment mènent exclusivement aux aurones de configuration Z au niveau de la double liaison exocyclique. Cette configuration est par ailleurs la seule présente dans la nature.
Activités découvertes
Si le potentiel biologique des aurones semble prometteur[4], cette classe de molécules n’a été que très peu étudiée par rapport à d’autres flavonoïdes plus abondants, comme les flavones ou les chalcones. Néanmoins, des études ont montré que des dérivés d’aurones peuvent se révéler actifs dans le traitement de tumeurs cancéreuses et comme agents antiparasitaires, antimicrobiens, antihormonaux, antimétaboliques ou antioxydants. Plus récemment, il a été montré que les aurones peuvent constituer de bons inhibiteurs de la tyrosinase[5], et leur potentiel de détection des plaques amyloïdes caractéristiques de la maladie d'Alzheimer a été mis au jour.
Notes et références
- (en) The Flavonoids: Advances in Research Since 1986, Brouillard, R.; Dangles, O., Chapman & Hall, London, 1993, pp. 565-588. [lire en ligne]
- (en)T.A. Geissman, C.D. Keaton, « Anthochlor pigments. IV. The pigments of Coreopsis grandiflora, Nutt. I. », dans Journal Of American Chemical Society, 65 (1943), p. 677-685.
- (en) Atta-ur-Rahman, M.I. Choudhary, S. Hayat, A.M. Khan, A. Ahmed, « Two new aurones from marine brown alga Spatoglossum variabile », dans Chemical Pharmaceutical Bulletin, 49 (2001), p. 105-107.
- (en)A. Boumendjel, « Aurones : a subclass of flavones with promising biological potential », dans Current Medicinal Chemistry, 10 (2003), p. 2621-2630.
- (en)S. Okombi, D. Rival, S. Bonnet, A.-M. Mariotte, E. Perrier, A. Boumendjel, « Discovery of benzylidenebenzofuran-3(2H)-one (aurones) as inhibitors of tyrosinase derived from human melanocytes », dans Journal Of Medicinal Chemistry, 49 (2006), p. 329-333.