Anthracène-magnésium
L'anthracène-magnésium[alpha 1] est un composé organométallique dérivant formellement de l'addition d'un atome de magnésium sur une molécule d'anthracène. Cet organomagnésien est dégradé par oxydation et hydrolyse au contact de l'air et de traces d'humidité. Il est généralement disponible sous forme d'adduit avec le THF.
| Complexe anthracène-magnésium-THF | |||
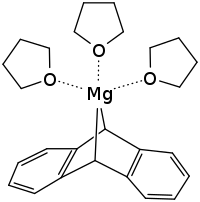
| |||
| Structure de l'anthracène-magnésium complexé avec trois molécules de THF | |||
| Identification | |||
|---|---|---|---|
| Synonymes |
(en) magnesium anthracene |
||
| No CAS | |||
| No ECHA | 100.210.465 | ||
| No CE | 685-033-4 | ||
| PubChem | 11668903 | ||
| SMILES | |||
| InChI | |||
| Apparence | poudre orangée | ||
| Propriétés chimiques | |||
| Formule | C26H34MgO3 |
||
| Masse molaire[1] | 418,851 4 ± 0,024 7 g/mol C 74,56 %, H 8,18 %, Mg 5,8 %, O 11,46 %, |
||
| Propriétés physiques | |||
| T° fusion | ~200 °C[2] | ||
| Précautions | |||
| SGH[2] | |||
 Danger |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Il a été synthétisé pour la première fois en 1965 et a fait l'objet d'études systématiques à partir des années 1980[3] parallèlement aux recherches sur l'hydrure de magnésium MgH2 pour le stockage de l'hydrogène. Il offre en effet une voie de synthèse vers le MgH2 sensiblement plus simple que la voie utilisée jusqu'alors, qui consistait à faire réagir de l'hydrogène sur du magnésium métallique à 500 °C sous 200 atm ; l'anthracène-magnésium permet au contraire de produire l'hydrure de magnésium à partir d'hydrogène dans des conditions de pression et de température quasiment normales[4].
On peut obtenir l'anthracène-magnésium avec un bon rendement en faisant réagir de l'anthracène et du magnésium métallique dans le tétrahydrofurane et le dibromométhane à une température de 20 à 60 °C. La substance pure est obtenue par lavage au tétrahydrofurane. La réaction s'inverse par chauffage, redonnant les produits de départ.
Outre son utilisation pour produire de l'hydrure de magnésium, l'anthracène-magnésium peut être utilisé pour produire des réactifs de Grignard sans partir du magnésium métallique[5].
Notes et références
- Les sources relatives à cette substance sont essentiellement anglophones, et désignent cette espèce chimique sous le nom magnesium anthracene, voire magnesiumanthracene en un seul mot, et parfois anthracene magnesium. En l'absence de source francophone, il a été choisi de traduire simplement le nom anglais, sans préposition.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Magnesiumanthracene tetrahydrofuran complex, consultée le 3 novembre 2018.
- (en) Borislav Bogdanovic, « Magnesium anthracene systems and their application in synthesis and catalysis », Accounts of Chemical Research, vol. 21, no 7, , p. 261-267 (DOI 10.1021/ar00151a002, lire en ligne)
- (en) Borislav Bogdanović, Shih‐tsien Liao, Manfred Schwickardi, Peter Sikorsky et Bernd Spliethoff, « Catalytic Synthesis of Magnesium Hydride under Mild Conditions », Angewandte Chemie International Edition, vol. 19, no 10, , p. 818-819 (DOI 10.1002/anie.198008181, lire en ligne)
- (en) Colin L. Raston et Geoffrey Salem, « Magnesium anthracene: an alternative to magnesium in the high yield synthesis of Grignard reagents », Journal of the Chemical Society, Chemical Communications, no 24, , p. 1702-1703 (DOI 10.1039/C39840001702, lire en ligne)

