Acyloïne
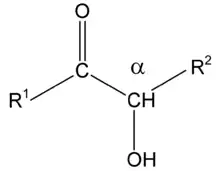
Les acyloïnes ou α-hydroxycétones sont une classe de composés organiques possédant un groupe carbonyle et un groupe hydroxyle sur le carbone en α du groupe carbonyle. Elles diffèrent ainsi des cétols qui ont le groupe carboxyle sur le carbone en β. On appelle benzoïnes les composés où les substituants R1 et R2 sont des noyaux benzéniques.
Propriétés
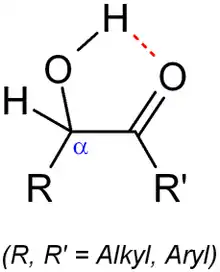
Les acyloïnes sont stabilisés par la formation d'une liaison hydrogène entre l'hydrogène de la fonction hydroxyle et l'oxygène de la fonction carbonyle.
Synthèse
Il existe plusieurs réactions organiques classiques permettent la synthèse des acyloïnes :
- la condensation acyloïnique, un couplage réductif d'esters;
- la condensation benzoïnique, une réaction de condensation entre aldéhydes catalysée par un nucléophile;
- l'oxydation d'un composé carbonylé par du dioxygène, mais la réaction n'est pas sélective; une meilleure alternative est l'oxydation de l'éther de silyl énol correspondant, par le mCPBA dans l'oxydation de Rubottom;
- l'oxydation MoOPH d'un composé carbonylé (par un réactif composé de peroxyde de molybdène, de pyridine et d'hexaméthylphosphoramide).
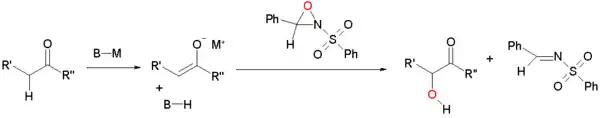
Oxydation d'énolate par des sulfonyloxaziridines
Les énolates peuvent être oxydés par les sulfonyloxaziridines[1] - [2]. Ils réagissent par déplacement nucléophile par l'atome d'oxygène en déficit d'électron du cycle d'oxaziridine.
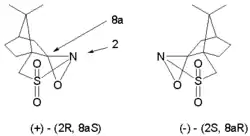
Ce type de réaction est modifiée pour faire une synthèse asymétrique par l'utilisation d'oxaziridines chirales dérivées du camphre (oxaziridine de camphresulfonyle). Chaque isomère donne accès exclusif à l'un des deux énantiomère possible. Cette modification est par exemple appliquée dans la synthèse totale d'Holton du taxol.
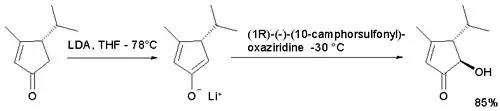
Dans l'oxydation d'énolate de la cyclopenténone[3], on obtient l'isomère trans, peu importe l'énantiomère de camphre utilisé, car la position cis est encombrée stériquement pour le groupe hydroxyle. L'utilisation d'une oxaziridine standard ne permet pas de synthétiser une acyloïne.
Réactions
- La réduction d'une acyloïne donne un diol.
- L'oxydation d'une acyloïne donne une dione.
- Certaines acyloïnes se réarrangent avec interversion de position, en milieu basique, par la transformation de Lobry de Bruyn-van Ekenstein.
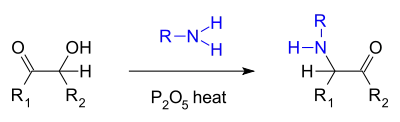
- Une réaction similaire, appelée « amination de Voight »[4] fait réagire une acyloïne avec une amine primaire et le pentoxyde de phosphore pour former une alpha-céto amine[5] :
- Synthèse d'indole[6], proche de la synthèse de Bischler-Möhlau
Notes et références
- Franklin A. Davis, Lal C. Vishwakarma, Joanne G. Billmers, John Finn, "Synthesis of .alpha.-hydroxycarbonyl compounds (acyloins): direct oxidation of enolates using 2 sulfonyloxaziridines", Journal of Organic Chemistry, 49(17), 1984, p. 3241-3243, Abstract
- F. A. Davis, M. S. Haque, T. G. Ulatowski, J. C. Towson, "Asymmetric Oxidation of Ester and Amide Enolates Using New (Camphorylsulfony1)oxaziridines", Journal of Organic Chemistry, 51, 1986, p. 2402, Abstract
- Chambers C. Hughes, Aubry K. Miller, et Dirk Trauner, "An Electrochemical Approach to the Guanacastepenes", Organic Letters, vol. 7, no. 16, 2005, p. 3425-3428 Consulter l'article
- (en) E. von Meyer, Karl Voigt, « Ueber die Einwirkung von primären aromatischen Aminen auf Benzoïn », Journal für praktische Chemie, vol. 34, , p. 1–27 (DOI 10.1002/prac.18860340101)
- Amines: Synthesis, Properties and Applications Stephen A. Lawrence 2004 Cambridge University Press (ISBN 978-0-521-78284-5)
- Roth, Lepke (1971): Archiv der Pharmazie, 159
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Acyloine » (voir la liste des auteurs).