Acide nitrosylsulfurique
L’acide nitrosylsulfurique est un composé chimique de formule (NO)HSO4. Il s'agit d'un solide incolore cristallisé utilisé dans l'industrie pour produire le caprolactame (CH2)5C(O)NH[4], précurseur du nylon 6.
| Acide nitrosylsulfurique | |
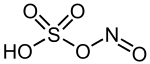 Structure de l'acide nitrosylsulfurique |
|
| Identification | |
|---|---|
| Synonymes |
acide nitrosulfonique, |
| No CAS | |
| No ECHA | 100.029.058 |
| No CE | 231-964-2 |
| PubChem | 82157 |
| SMILES | |
| InChI | |
| Apparence | cristaux incolores à l'odeur piquante |
| Propriétés chimiques | |
| Formule | HNO5S [Isomères] |
| Masse molaire[1] | 127,077 ± 0,007 g/mol H 0,79 %, N 11,02 %, O 62,95 %, S 25,23 %, |
| Propriétés physiques | |
| T° fusion | décomposition à 73,5 °C[2] |
| Précautions | |
| SGH[3] | |
  Danger |
|
| Transport[3] | |
| Unités du SI et CNTP, sauf indication contraire. | |
L'acide nitrosylsulfurique se forme lorsqu'on fait réagir des oxydes d'azote avec de l'acide sulfurique H2SO4 concentré, par exemple comme sous-produit du procédé des chambres de plomb. Cette molécule peut également être vue comme l'anhydride d'acide sulfurique et d'acide nitreux HNO2, et peut être obtenue en introduisant du dioxyde de soufre SO2 dans de l'acide nitrique HNO3[5].
On utilise l'acide nitrosylsulfurique industriellement pour produire le caprolactame, ainsi que des colorants et des pesticides. Il est également utilisé en chimie organique pour préparer des sels de diazonium à partir d'amines ; les réactifs apportant le groupe nitroso NO peuvent alors être le tétrafluoroborate de nitrosyle (NO)BF4 ou le chlorure de nitrosyle NOCl par exemple.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Nitrosylsulfuric acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 26 décembre 2014 (JavaScript nécessaire)
- (en) Josef Ritz, Hugo Fuchs, Heinz Kieczka et William C. Moran, « Caprolactam », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a05_031, lire en ligne)
- (en) George H. Coleman, Gerald A. Lillis, Gilbert E. Goheen, C. V. Herrmann et H. S. Booth, « Nitrosyl Chloride », Inorganic Syntheses, vol. 1, (DOI 10.1002/9780470132326.ch20, lire en ligne)
