2-Méthylimidazole
Le 2-méthylimidazole est un composé organique solide blanc ou incolore très soluble dans les solvant organiques polaires et structurellement apparenté à l'imidazole. Très irritant, l'Agence européenne des produits chimiques (ECHA) a ajouté le 2-méthylimidazole à la liste des substances extrêmement préoccupantes (SVHC) dans la catégorie "Toxic for reproduction"[4]. C'est un précurseur de plusieurs médicaments ainsi qu'un ligand en chimie de coordination.
| 2-Méthylimidazole | |||
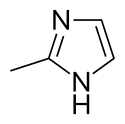
| |||
| Structure du 2-méthylimidazole | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | 2-méthyl-1H-imidazole | ||
| No CAS | |||
| No ECHA | 100.010.697 | ||
| No CE | 211-765-7 | ||
| No RTECS | NI7175000 | ||
| PubChem | 12749 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C4H6N2 [Isomères] |
||
| Masse molaire[1] | 82,103 8 ± 0,004 g/mol C 58,51 %, H 7,37 %, N 34,12 %, |
||
| Précautions | |||
| SGH[2] | |||
   Danger |
|||
| Transport[2] | |||
|
|||
| Écotoxicologie | |||
| DL50 | 1 300 mg·kg-1 (souris, oral)[3] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
On l'obtient par synthèse de Radziszewski (en) en faisant réagir du glyoxal HOC–CHO, de l'ammoniac NH3 et de l'acétaldéhyde CH3CHO. La nitration donne un dérivé 5-nitro[3].
On peut l'utiliser pour simuler le résidu d'histidine coordonné à l'hème dans les hémoprotéines biologiques. Il peut être déprotoné pour réaliser des polymères de coordination (en) à base d'imidazole[5].
C'est également un précurseur de plusieurs antibiotiques de la classe des nitroimidazoles, utilisés contre des parasitoses et des infections à bactéries anaérobies[6] - [3].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé 2-Methylimidazole Green Alternative 99%, consultée le 30 octobre 2016.
- (en) Klaus Ebel, Hermann Koehler, Armin O. Gamer et Rudolf Jäckh, « Imidazole and Derivatives », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a13_661)
- (en) European Chemicals Agency, « Inclusion of substances of very high concern in the Candidate List for eventual inclusion in Annex XIV. Doc : D(2020)4578-DC », sur https://echa.europa.eu/, (consulté le )
- (en) Rahul Banerjee, Anh Phan, Bo Wang, Carolyn Knobler, Hiroyasu Furukawa, Michael O'Keeffe et Omar M. Yaghi, « High-Throughput Synthesis of Zeolitic Imidazolate Frameworks and Application to CO2 Capture », Science, vol. 319, no 5865, , p. 939-943 (PMID 18276887, DOI 10.1126/science.1152516, Bibcode 2008Sci...319..939B, lire en ligne)
- (en) David I. Edwards, « Nitroimidazole drugs – action and resistance mechanisms. I. Mechanisms of action », Journal of Antimicrobial Chemotherapy, vol. 31, no 1, , p. 9-20 (PMID 8444678, DOI 10.1093/jac/31.1.9, lire en ligne)