Érythrocruorine
L'érythrocruorine est un complexe protéique de la famille des globines assurant le transport de l'oxygène chez divers annélides et arthropodes, dont certains insectes. Il s'agit d'une très grosse molécule d'environ 3 500 kDa[2], constituée de plus d'une centaine de sous-unités, ayant le même groupe prosthétique que la chlorocruorine. Elle est présente librement dans le sang et le cœlome de l'animal, et n'est pas encapsulée dans des cellules. Un exemple d'érythrocruorine est celle du ver de terre commun, constituée de douze hétérododécamères, soit 144 sous-unités de globines A, B, C et D et 36 protéines de liaison[1], tandis que celle de Daphnia magna est constitué de 16 sous-unités portant deux molécules d'hème chacune[3].
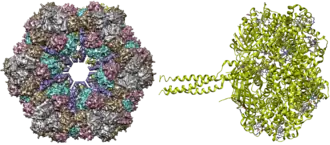
L'affinité de l'érythrocruorine pour l'oxygène est plus élevée que celle de l'hémoglobine car elle est adaptée aux conditions d'hypoxie qui prévalent dans l'habitat des animaux qui utilisent cette protéine, comme les sédiments et l'estran.
Notes et références
- (en) William E. Royer Jr., Hitesh Sharma, Kristen Strand, James E. Knapp et Balaji Bhyravbhatla, « Lumbricus Erythrocruorin at 3.5 Å Resolution: Architecture of a Megadalton Respiratory Complex », Structure, vol. 14, no 7, , p. 1167-1177 (PMID 16843898, DOI 10.1016/j.str.2006.05.011, lire en ligne)
- (en) William E. Royer Jr., Kristen Strand, Marin van Heel et Wayne A. Hendrickson, « Structural hierarchy in erythrocruorin, the giant respiratory assemblage of annelids », Proceedings of the National Academy of Sciences of the United States of America, vol. 97, no 13, , p. 7107-7111 (PMID 10860978, PMCID 16507, DOI 10.1073/pnas.97.13.7107, lire en ligne)
- (en) E. Ilan, E. Weisselberg et E. Daniel, « Erythrocruorin from the water-flea Daphnia magna. Quaternary structure and arrangement of subunits », Biochemical Journal, vol. 207, no 2, , p. 297-303 (PMID 7159384, PMCID 1153860, DOI 10.1042/bj2070297, lire en ligne)