Éminence ganglionnaire
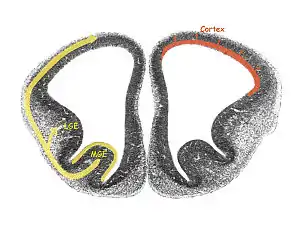
L'éminence ganglionnaire (EG) est une structure transitoire dans le développement du système nerveux qui guide la migration des cellules et des axones[1]. Elle est présente dans les stades embryonnaires et fœtaux du développement neural que l'on trouve entre le thalamus et le noyau caudé[1].
| Système |
|---|
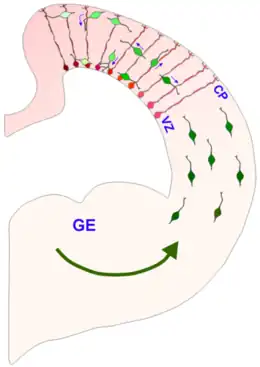
L'éminence est divisée en trois régions de la zone ventriculaire ventrale du télencéphale (une éminence latérale, médiale et caudale), où elles facilitent la migration cellulaire tangentielle au cours du développement embryonnaire . La migration tangentielle n'implique pas d'interactions avec les cellules gliales radiales ; au lieu de cela, les interneurones migrent perpendiculairement à travers les cellules gliales radiales pour atteindre leur emplacement final. Les caractéristiques et la fonction des cellules qui suivent la voie de migration tangentielle semblent être étroitement liées à la localisation et au moment de leur production[2], et les EG contribuent de manière significative au développement des cellules corticales GABAergiques[1] - [3] - [4]. Une autre structure à laquelle les EG contribuent est les noyaux de la base[5]. Les EG guident également les axones qui poussent du thalamus vers le cortex et vice versa[1].
Chez l'homme, les EG disparaissent à l'âge d'un an[1]. Au cours du développement, la migration neuronale se poursuit jusqu'à l'extinction de la couche germinale, moment auquel les restes de la couche germinale constituent les éminences[1].
Catégorisation
Les éminences ganglionnaires sont classées en trois groupes en fonction de leur emplacement dans la zone sous-ventriculaire :
- Éminence ganglionnaire médiale (EGM) ;
- Éminence ganglionnaire latérale (EGL) ;
- Éminence ganglionnaire caudale (EGC)[6].
Un sillon sépare les éminences ganglionnaires médiales et latérales. L'expression de Nkx2-1, <i id="mwOw">Gsx2</i> et Pax6 est nécessaire pour déterminer les populations de cellules progénitrices indépendantes dans le EGL et le EGM. Les interactions entre ces trois gènes définissent les frontières entre les différentes zones progénitrices et les mutations de ces gènes peuvent provoquer une expansion anormale autour de la EGM, de la EGL, du pallium ventral (VP) et de la région entopeduncular antérieure (AEP). Les cellules des GE sont assez homogènes, les EGM, EGL et EGC ayant toutes des noyaux petits, sombres et irréguliers et un cytoplasme modérément dense, cependant, chaque éminence peut être identifiée par le type de descendance qu'elle produit[6].
De plus, la zone sous-ventriculaire est le point de départ de multiples flux d'interneurones en migration tangentielle qui expriment les gènes <i id="mwQg">Dlx</i>. Trois principales voies de migration tangentielle ont été identifiées dans cette région :
- la migration latéro-caudale (télencéphale subpallial au cortex) ;
- la migration médio-rostrale (télencéphale basal sous-pallé vers le bulbe olfactif) ;
- la migration latéro-caudale (télencéphale basal vers le striatum).
Ces voies sont temporellement et spatialement distinctes et produisent une variété d'interneurones GABAergiques et non GABAergiques. Un exemple d'interneurones GABAergiques que les GE guident sont les interneurones contenant de la parvalbumine dans le néocortex. Quelques exemples d'interneurones non GABAergiques que les GE guident sont les interneurones dopaminergiques dans le bulbe olfactif et les interneurones cholinergiques dans le striatum. Les cellules migrant le long de ces voies se déplacent à des rythmes différents. Certaines molécules qui ont été impliquées dans le contrôle de la vitesse du mouvement unidirectionnel des cellules dérivées des GE sont le facteur de croissance des hépatocytes /facteur dispersé (HGF/SF) et divers facteurs neurotrophiques[2].
Éminence ganglionnaire médiale (EGM)
L'objectif principal du EGM au cours du développement est de produire des cellules étoilées GABAergiques et de diriger leur migration vers le néocortex[6]. Les précurseurs de la plupart des interneurones GABAergiques du cortex cérébral migrent depuis la zone progénitrice sous-corticale. Plus précisément, la réalisation d'une section mécanique de la route migratoire du EGM au néocortex provoque une diminution de 33 % des interneurones GABAergiques dans le néocortex[6]. Le EGM produit également certains des neurones et de la glie des noyaux gris centraux et de l'hippocampe[6] - [7]. Le EGM peut également être une source de cellules de Cajal-Retzius, mais cela reste controversé[6]. Au début du développement embryonnaire, les interneurones du cortex proviennent principalement du EGM [8] et de l'AEP. Des expériences in vitro montrent que les cellules EGM migrent à plus de 300 µm par jour, trois fois plus vite que la migration des cellules EGL[9].
Éminence ganglionnaire latérale (EGL)
Par rapport au cadre temporel précoce du développement dans le EGM, le EGL aide à la migration tangentielle des cellules plus tard au stade mi-embryogénique. Contrairement au EGM, qui guide la plupart des migrations cellulaires dans le cortex au cours de cette étape, le EGL contribue moins à la migration cellulaire vers le cortex et guide plutôt de nombreuses cellules vers les bulbes olfactifs. En effet, la migration vers le bulbe olfactif est conduite par le EGL jusqu'à l'âge adulte. La route que les neurones nouvellement générés empruntent de la zone sous-ventriculaire antérieure au bulbe olfactif s'appelle le flux migratoire rostral . Au cours des derniers stades du développement embryonnaire, la EGL et la EGM guident la migration des cellules vers le cortex, en particulier les régions prolifératives du cortex[9]. Certaines études ont montré que le EGL contribue également aux cellules du néocortex, mais cela reste un sujet de débat[6] In vitro, les cellules migrant du EGL voyagent à une vitesse de 100 m par jour, plus lentement que les cellules EGM[9].
Éminence ganglionnaire caudale (EGC)
L'éminence ganglionnaire caudale est une autre structure sous-corticale essentielle à la génération des interneurones corticaux. Il est situé à côté du ventricule latéral, en arrière de l'endroit où le EGL et le EGM fusionnent[6]. Le EGC est une fusion de l'éminence ganglionnaire médiale rostrale et latérale, qui commence au milieu du thalamus caudal. Il existe deux domaines moléculaires qui existent dans le EGC et ressemblent étroitement à des extensions du EGM et du EGL caudal[10]. Le EGC est distinct du EGL et du EGM dans les modèles d'expression génique et la descendance produite. Contrairement aux cellules du EGM, les cellules du EGC étaient rarement des neurones contenant de la parvalbumine. Il semble que la majorité des cellules du EGC étaient des interneurones GABAergiques, mais selon leur localisation, les cellules dérivées du EGC sont très diverses. Les cellules dérivées de EGC comprennent les interneurones GABAergiques, les interneurones épineux, les cellules moussues, les neurones pyramidaux et granulaires, et même les cellules gliales oligodendrocytes et astrocytes.[6]
Migration cellulaire
Les cellules de l'éminence ganglionnaire migrent tangentiellement vers le néocortex, donnant naissance à des interneurones. Une variété de mécanismes moléculaires coopèrent pour diriger ce processus. La migration interneuronale embryonnaire vers le cortex cérébral est médiée par un ensemble de facteurs de croissance motogéniques dans le EGM, des facteurs répulsifs dans le striatum et le EGL, des facteurs permissifs dans les couloirs migratoires de l'éminence ganglionnaire et des facteurs attractifs dans le cortex lui-même[3]. Les cellules du EGL migrent vers le domaine striatal ( noyau caudé et putamen ) et des parties du septum et de l' amygdale . Les cellules EGM suivent un chemin migratoire vers le globus pallidus et une partie du septum. Le EGC donne naissance à des interneurones dans le noyau accumbens, le noyau lit des stries terminales, l' hippocampe et des noyaux spécifiques dans l'amygdale . Cette migration dirigée est induite par des différences d'expression génique entre ces domaines subpalliaux[11]. Un ensemble de gènes sont impliqués dans la différenciation et la spécification des interneurones et des oligodendrocytes, notamment : Dlx1, Dlx2, Gsh1, Mash1, Gsh2, Nkx2.1, Nkx5.1, Isl1, Six3 et Vax1[11].
Mécanismes moléculaires de la migration dirigée
La migration induite des cellules de l'éminence ganglionnaire au cours du développement est dirigée par une variété de facteurs motogéniques, des molécules qui augmentent la motilité cellulaire et des molécules chimiotactiques. Le facteur motogénique HGF/SF améliore la motilité cellulaire et éloigne les cellules des régions subpalliales et délimite les routes suivies par les cellules en migration. Les neurotrophines, telles que le BDNF, sont une famille de facteurs motogéniques impliqués dans la direction de la migration. Le cortex cérébral fournit des molécules chimioattractantes (par exemple NRG1 de type I et II dans le cortex) tandis que les zones sous-pallées produisent des molécules chimiopulsives (par exemple Slit ) pour diriger la migration cellulaire. De plus, certains facteurs permissifs (tels que NRG1 de type III) dans les couloirs migratoires sont nécessaires pour que ce processus se produise[3] - [11].
Les neurotransmetteurs GABA et 5-HT ont également été impliqués dans la migration. Il a été observé que des concentrations élevées de GABA provoquent un mouvement cellulaire aléatoire (« migration à pied aléatoire »), tandis que de faibles concentrations favorisent une migration dirigée. La 5-HT a été liée au processus d'incorporation des interneurones dans la plaque corticale, ainsi qu'à la différenciation en sous-populations d'interneurones[11].
Troubles associés
La migration des cellules de la zone ventriculaire vers leur destination prévue et le succès de leur différenciation peuvent être interrompus de différentes manières, dont l'interférence avec les moteurs mécaniques ou une altération des signaux moléculaires qui initient le mouvement, conduisent la cellule dans la migration et terminent sa migration. La fonction des molécules qui affectent la migration ne se limite pas au mouvement cellulaire, chevauchant considérablement les événements associés à la neurogenèse . En conséquence, les syndromes de migration neuronale sont difficiles à classer. La plus grande classe de syndromes de migration neuronale est la lissencéphalie. Cela comprend un spectre de cortex simplifié allant de l'agyrie (absence totale de circonvolutions corticales) à la pachygyrie (gyri élargi) avec un cortex inhabituellement épais.
Une mauvaise migration des neurones peut également entraîner une hétérotopie nodulaire périventriculaire bilatérale, une maladie caractérisée par une hétérotopie neuronale tapissant les ventricules latéraux. Le syndrome de Zellweger est caractérisé par une dysplasie corticale similaire à la polymicrogyrie du cortex cérébral et cérébelleux, parfois avec une pachygyrie entourant la fissure sylvienne et une hétérotopie focale/sous-épendymaire. Le syndrome de Kallmann est reconnu par une anosmie associée à un retard mental, un hypogonadisme et un défaut de développement du bulbe olfactif.
Les troubles de la projection et de l'assemblage axonal sont rarement purs, mais étroitement liés aux gènes de la migration neuronale. Cela inclut notamment l'agénésie du corps calleux.
Des perturbations dans la genèse des éléments neuronaux peuvent entraîner une dysplasie corticale . Les exemples incluent la neurogenèse ectopique, la microencéphalie et la survie cellulaire altérée entraînant des zones d' hyperplasie, une apoptose réduite et une hétérotopie[12].
Perspectives de recherches
Des recherches supplémentaires pourraient être menées sur la migration des cellules des noyaux gris centraux vers le néocortex. Les mécanismes moléculaires qui contrôlent ce phénomène ne sont pas encore complètement clarifiés. Le nombre de mutations connues qui pourraient interférer avec la migration neuronale augmente rapidement et continuera de le faire à mesure que de nouvelles recherches seront effectuées. La complexité des étapes moléculaires nécessaires pour placer correctement les cellules dans un système aussi compliqué que le cerveau est impressionnante, et à mesure que de plus en plus de pièces de ce puzzle complexe apparaîtront, il sera plus facile de trouver des stratégies pour remédier aux troubles associés à la migration neuronale, et pour potentiellement réparer les dommages causés par les traumatismes, les accidents vasculaires cérébraux, le mal-développement et le vieillissement[12].
Références
- Encha-Razavi & Sonigo. (2003). Features of the developing brain. Child's Nervous System. pp. 426-428
- (en) Marín et Rubenstein, « A long, remarkable journey: tangential migration in the telencephalon. », Nature Reviews. Neuroscience, vol. 2, no 11, , p. 780–90 (PMID 11715055, DOI 10.1038/35097509)
- (en) Ghashghaei, Lai et Anton, « Neuronal migration in the adult brain: are we there yet? », Nature Reviews. Neuroscience, vol. 8, no 2, , p. 141–51 (PMID 17237805, DOI 10.1038/nrn2074)
- Hernández-Miranda, Parnavelas, & Chiara. (2010). Molecules & mechanisms involved in the generation and migration of cortical interneurons. ASN Neuro, 2(2). pp. 75-86
- Purves, D., Augustine, G., Fitzpatrick, D., Hall, W., LaMantia, A.S., McNamara, J., and White, L., Neuroscience. 4th ed., Sinauer Associates, , 555–8 p. (ISBN 978-0-87893-697-7)
- Brazel, Romanko, Rothstein et Levison, « Roles of the mammalian subventricular zone in brain development. », Progress in Neurobiology, vol. 69, no 1, , p. 49–69 (PMID 12637172, DOI 10.1016/s0301-0082(03)00002-9)
- Sanes, Reh, & Harris. (2012). Development of the Nervous System. 3rd ed. Academic Press. pp. 62-63. (ISBN 978-0-12-374539-2).
- Lavdas, Grigoriou, Pachnis, & Parnavelas. (1999). The medial ganglionic eminence gives rise to a population of early neurons in the developing cerebral cortex. The Journal of Neuroscience, 99(19). pp. 7881-7888.
- Marín et Rubenstein, « A long, remarkable journey: tangential migration in the telencephalon. », Nature Reviews. Neuroscience, vol. 2, no 11, , p. 780–90 (PMID 11715055, DOI 10.1038/35097509)
- Wonders et Anderson, « The origin and specification of cortical interneurons. », Nature Reviews. Neuroscience, vol. 7, no 9, , p. 687–96 (PMID 16883309, DOI 10.1038/nrn1954)
- Hernández-Miranda, Parnavelas, & Chiara. (2010). Molecules & mechanisms involved in the generation and migration of cortical interneurons. ASN Neuro, 2(2). pp. 75-86.
- Ross, M. E., & Walsh, C. A. (2001). Human brain malformations and their lessons for neuronal migration. Annual Review of Neuroscience, 24(1), 1041-1070.
Voir aussi
Ouvrage
- Dale Purves, George J. Augustine, David Fitzpatrick, William C. Hall, Anthony-Samuel LaMantia, James O. McNamara et S. Mark Williams, Neurosciences, Bruxelles, De Boeck Université, coll. « Neurosciences & Cognition », , 6e éd., 811 p. (ISBN 978-2-8073-1492-4, lire en ligne)
- (en) Eric R. Kandel, James H. Schwartz et Thomas M. Jessel, Principles of neural science, , 5e éd. (ISBN 978-0-07-139011-8 et 0-07-139011-1, OCLC 795553723, lire en ligne)