Virus de l'hépatite C
Le virus de l'hépatite C (VHC, l'abréviation anglaise HCV « Hepatitis C Virus » est aussi utilisée en français) est un petit virus enveloppé, d'environ 60 nm[1] de diamètre, dont le génome est un ARN monocaténaire linéaire de polarité positive contenu dans une capside protéique icosaédrique[2]. Il présente une grande variabilité génétique : six génotypes différents ont été caractérisés et un septième a été identifié plus récemment.
— auteur incomplet —, date à préciser
— auteur incomplet —, date à préciser
Il est responsable de l'hépatite C. Sa prévalence au Canada, en France et en Belgique est d'environ 1 %[3] ; elle grimpe jusqu'à 22 % dans certaines régions d'Afrique (Égypte par exemple)[4]. Son mode de transmission est par le sang, essentiellement parentéral (piqûre, écorchure…) et dans une moindre mesure conséquence d'un contact sexuel avec une exposition au sang. Au Canada, où les risques de contamination via les banques de sang sont à toute fin pratique inexistants, la plupart des infections sont contractées via l'utilisation de drogues injectables avec une aiguille usagée.
Ses corécepteurs connus sont des glycosaminoglycanes, SR-B1, CD81 (en) et la claudine-1.
Il est le seul représentant du genre Hepacivirus, au sein de la famille des Flaviviridae qui compte deux autres genre les Pestivirus (en) et les Flavivirus.
De nos jours, l'hépatite C infecte environ 3 % de la population mondiale, soit approximativement 170 millions de personnes[5].
En , le prix Nobel de Physiologie ou Médecine a été attribué à Harvey J. Alter, Michael Houghton et Charles M. Rice pour leur découverte du virus de l'hépatite C.[6]
Structure
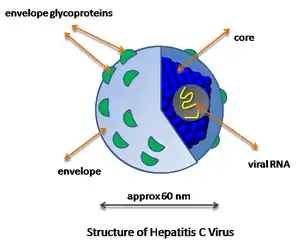
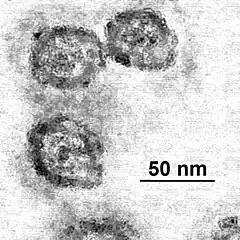
Les particules HCV sont associées à des composants lipoprotéiniques de très faible densité chez les patients chroniques. Ces particules hybrides, dites particules lipovirales ou LVP (lipo-viro particles), sont riches en triglycérides et contiennent l'ARN viral, la protéine de capside, les glycoprotéines d'enveloppe E1E2 et les alipoprotéines B et E.
La morphologie des particules virales a été caractérisée par immunocapture, directement sur les grilles d'un microscope électronique en transmission, permettant ainsi de préserver la structure des LVP[7] - [8]. Chacune est constituée d'une large nucléocapside entourant une partie centrale riche en électrons, probablement le génome viral. Cette capside est elle-même entourée par un croissant irrégulier sensible aux détergents, probablement composé de lipides. La taille de la particule est plausiblement déterminée par ses composants lipidiques. Les résultats suggèrent aussi que le sérum des patients comporte, outre ces particules LVP, des protéines semblables aux lipoprotéines ainsi que des particules virales complètes.
Génome
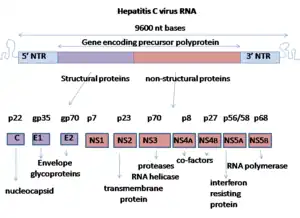
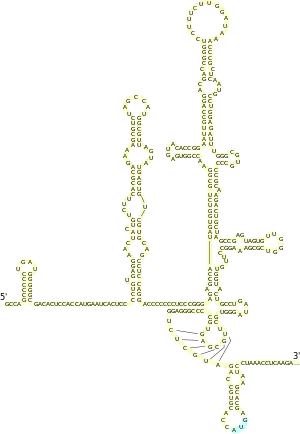
Le génome du virus de l'hépatite C est composé d'un ARN simple brin à polarité positive, long de 9 600 nucléotides, qui code une polyprotéine unique d'environ 3 000 acides aminés. Le génome du VHC se compose de trois parties. La région 5’ non codante, qui est constituée de 341 à 344 nucléotides, est structurée en quatre domaines tige boucle. C’est une région très organisée et hautement conservée avec une similarité qui atteint au minimum 90 % pour les souches de VHC entre elles. Cette région permet la fixation de la sous-unité 40S du ribosome au niveau de l’IRES (Internal Ribosome Entry Site) rendant ainsi possible l’initiation de la traduction (de manière coiffe indépendante), enfin la région 5’ NC porte le signal d’encapsidation nécessaire à la formation de la nucléocapside.
La région 3’ non codante présente une longueur variable de 200 à 235 nt, elle est constituée (de 5’ en 3’) d’une région non traduite directement en aval de la protéine NS5B d’une longueur comprise entre 20 nt et 70 (de composition est variable en fonction des isolats mais fortement conservée de manière intra génotypique), d’une région polyuridylée de longueur variable (30 à 150 pb) puis de la région X comprenant 98 nucléotides et qui est hautement conservée. La région X et la région polyuridylée semble dans l’infectivité du VHC.
Enfin le cadre de lecture ouvert (ou ORF, Open Reading Frame) est de taille variable (9 024 à 9 111 nucléotides) selon les isolats. Elle code une polyprotéine qui est clivée co- et post-traductionnellement en dix protéines, en suivant la séquence suivante NH2-Capside-E1-E2-p7-NS2-NS3-NS4A-NS4B-NS5A-NS5B-COOH. Deux types de protéines sont alors produites, les protéines structurales et les protéines non structurales.
- Les protéines structurales comportent la capside et les deux glycoprotéines d’enveloppe (E1 et E2)[2]. Il existe aussi une protéine appelée protéine p7 qui semble jouer un rôle essentiel dans la morphogenèse du virus[9].
- Les protéines non structurales assurent les fonctions enzymatiques utiles au cycle viral :
- NS2, qui est une protéine hydrophobe attachée à la membrane cellulaire (formé à partir de protéase NS2/3),
- NS3, qui est une protéase virale avec une fonction hélicase (hélicase du VHC),
- NS4A, qui est une protéine trans-membranaire cofacteur de NS3 (protéase NS3-4A),
- NS4B, qui est une protéine trans-membranaire responsable du réseau membranaire,
- NS5A, une phosphoprotéine virale,
- et enfin la polymérase virale NS5B.
Réplication
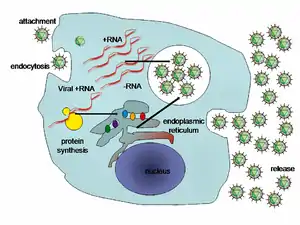
La particule infectieuse se lie aux récepteurs cellulaires via les glycoprotéines d'enveloppes E1 et E2. Différents récepteurs cellulaires sont impliqués dans cette reconnaissance : CD81, qui appartient à la famille des tétraspanines, SR-BI (Human Scavenger Receptor class B type 1) qui est une glycoprotéine exprimée principalement dans le foie, CLDN-1 qui est une protéine de la famille des claudines, également fortement exprimée dans le foie, elle interviendrait après les SR-BI et CD81[10]. Les CLDN6 (en) et CLDN9 (en) pourraient également participer à l’entrée du VHC. Enfin les OCLDN et le récepteur à l’EGF jouerait un rôle lors du processus d’entrée du virus dans la cellule.
Une fois la reconnaissance entre la particule virale et son récepteur établie, il y a fusion entre l’enveloppe virale et la membrane cellulaire à pH acide, induisant un changement de conformation de l’enveloppe virale, la décapsidation de la particule virale, et la libération de l’ARN positif du génome viral.
L’ARN (+) libéré est traduit grâce à la machinerie cellulaire (ribosomes, protéines cellulaires) au niveau du réticulum endoplasmique (RE). Les protéines virales synthétisées sont nécessaires à la réplication du virus. Elles sont associées dans le complexe de réplication au niveau des membranes du RE à proximité des gouttelettes lipidiques. Ensuite l'ARN (+) sert de brin matriciel pour la synthèse de l'intermédiaire de réplication, l’ARN (-), permettant la synthèse d’un grand nombre de brins positifs. Enfin internalisation des brins positifs dans les futures particules virales composées des protéines de capside et de E1 et E2 puis bourgeonnent à partir du RE. Le relargage extracellulaire des particules virales s’opère ensuite grâce à des vésicules d’exocytose vers la membrane cellulaire.
Notes et références
- Masahiko Kaito, Shozo Watanabe, Kyoko Tsukiyama-Kohara et Kenjiro Yamaguchi, « Hepatitis C virus particle detected by immunoelectron microscopic study », Journal of General Virology,, vol. 75, no 7, , p. 1755–1760 (ISSN 0022-1317, DOI 10.1099/0022-1317-75-7-1755, lire en ligne, consulté le )
- J.M. Pawlotsky, « Le virus de l'hépatite C », Médecine/sciences, vol. 18, , p. 303-314 (DOI 10.1051/medsci/2002183303, lire en ligne)
- 6. (PHAC-ASPC) Agence de Santé Publique du Canada. 2009. « hépatite C ». SSASH : Épidémiologie de l’infection aiguë par le virus de l’hépatite C au Canada, Résultats du système de surveillance accrue des souches de l’hépatite. En ligne. <http://www.phac-aspc.gc.ca/sti-its-surv-epi/pdf/hcv-epi-fra.pdf> [Consulté le 1er octobre 2011]
- (en) T. Sy et M.M. Jamal, « Epidemiology of hepatitis C (HCV) infection », Int. J. Med. Sci., vol. 3, , p. 41-46 (PMID 16614741, DOI doi:10.7150/ijms.3.41)
- WHO. Hepatitis C—global prevalence (update). Wkly Epidemiol Rec 1999;49:421-428
- The official website of the Nobel prize |https://www.nobelprize.org/prizes/medicine/2020/summary/
- Marie-Neige Cordonnier, « Le virus de l’hépatite C se dévoile enfin », Pour la science, no 470, , p. 7.
- (en) Eric Piver, Audrey Boyer, Julien Gaillard, Anne Bull, Elodie Beaumont, Philippe Roingeard et Jean-Christophe Meunier, « Ultrastructural organisation of HCV from the bloodstream of infected patients revealed by electron microscopy after specific immunocapture », Gut, (DOI 10.1136/gutjnl-2016-311726).
- (en) E. Steinmann, « Hepatitis C virus p7 protein is crucial for assembly and release of infectious virions », PLoS pathogens, vol. 3, no 7, (lire en ligne).
- (en) M.J. Evans, T. von Hahn, D.M. Tscherne, A.J. Syder, M. Panis, B. Wölk, T. Hatziioannou, J.A. McKeating, P.D. Bienasz et C.M. Rice, « Claudin-1 is a hepatitis C virus co-receptor required for a late step in entry », Nature, vol. 446, , p. 801-805 (DOI doi:10.1038/nature05654)