Violet de phtaléine
Le violet de phtaléine est un colorant de triarylméthane appartenant au groupe des phtaléines. Comme son analogue sulfuré, l'orange de xylénol, il est utilisé comme indicateur coloré en complexométrie.
| Violet de phtaléine | |
| |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.017.563 |
| No CE | 219-318-8 |
| SMILES | |
| InChI | |
| Apparence | Poudre cristalline beige |
| Propriétés chimiques | |
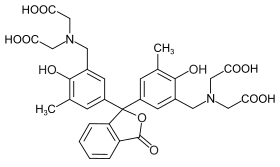
| Formule | C32H32N2O12 |
| Masse molaire[1] | 636,602 7 ± 0,031 8 g/mol C 60,37 %, H 5,07 %, N 4,4 %, O 30,16 %, |
| Diamètre moléculaire | nm |
| Propriétés physiques | |
| T° fusion | 186 °C[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
À température ambiante, il se présente sous la forme d'un solide beige inodore.
Propriétés
Le violet de phtaléine possède un cycle de lactone, quatre groupes carboxy, deux groupes amine et deux groupes phénol, chacun pouvant être protoné/déprotoné.
À pH 12-13, une solution de violet de phtaléine a une teinte rose. Sous cette forme, il peut former avec des cations métalliques divalents des complexes de violets assez pâles, qui sont détruits par l'ajout d'un complexant plus fort, tel que l'EDTA[3].
Utilisation
Le violet de phtaléine est utilisé comme le noir ériochrome T, en complexométrie comme indicateur coloré de la présence d'ions Ba2+, Ca2+, Cd2+, Mg2+ et Sr2+ .
On l'utilise principalement pour déterminer la dureté de l'eau et sa teneur en ions baryum et sulfates[4].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (de) fiche Merck
- M. Hübel, Ciba Geigy et al.: Laborpraxis 4, S. 123
- (de) Universität Ulm: Praktikum Analytische Chemie, Gravimetrie und Komplexometrie
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Metallphthalein » (voir la liste des auteurs).