Triiodure de bore
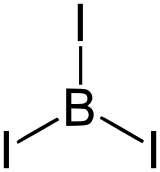
Le triiodure de bore est un composé chimique du bore et de l'iode de formule chimique BI3. Il a une géométrie moléculaire trigonale plane. C'est un solide cristallin, qui réagit vigoureusement avec l'eau pour former de l'acide borique[2]. Sa chaleur de vaporisation est de 40,5 kJ/mol. À des pressions extrêmement élevées, BI3 devient métallique à ~23 GPa et est un supraconducteur au-dessus de ~27 GPa[3].
| Triiodure de bore | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Triiodure de bore | |
| No CAS | ||
| No ECHA | 100.033.492 | |
| Apparence | solide cristallin | |
| Propriétés chimiques | ||
| Formule | BI3 |
|
| Masse molaire[1] | 391,524 ± 0,007 g/mol B 2,76 %, I 97,24 %, |
|
| Propriétés physiques | ||
| T° fusion | 49,9 °C | |
| T° ébullition | 210 °C | |
| Solubilité | dans l'eau : réaction | |
| Masse volumique | 3,35 g·cm-3 | |
| Pression de vapeur saturante | à 20 °C : | |
| Précautions | ||
| SGH | ||
 |
||
| Peau | provoque des brûlures | |
| Yeux | provoque des lésions oculaires graves | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Préparation
Le triiodure de bore peut être synthétisé par réaction du bore avec de l'iode à 209,5 °C . Il peut également être préparé par action du trichlorure de bore sur l'iodure d'hydrogène (à haute température):
- 3 HI + BCl3 → BI3 + 3 HCl
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Boron triiodide » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- http://www.sciencemadness.org/talk/files.php?pid=110072&aid=4171
- (en) Katsuya Shimizu, « Pressure-induced phase transition, metallization, and superconductivity in boron triiodide », Physical Review B, vol. 82, no 9, , p. 094506 (DOI 10.1103/PhysRevB.82.094506, lire en ligne, consulté le ).
Liens externes
Cet article est issu de wikipedia. Text licence: CC BY-SA 4.0, Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.