Transplantation rénale
La transplantation rénale, ou greffe de rein est une intervention chirurgicale consistant à remplacer un rein défectueux par un rein sain, prélevé sur un donneur. Selon la pathologie initiale, le greffon peut être posé sans que le rein ou les reins malades aient été retirés. Le rein transplanté est généralement greffé plus bas que la position anatomique normale, notamment dans la fosse iliaque.
| ICD10 | OTY |
|---|---|
| ICD9 | 55.6 |
| MeshID | D016030 |
| OPS301 | 5-555 |
| MedlinePlus | 003005 |
Il s'agit de la greffe la plus courante, elle possède un taux de réussite élevé. Elle est pratiquée chez les patients souffrant d'insuffisance rénale terminale afin d'améliorer leur qualité de vie, et de les libérer des contraintes des séances de dialyses. Cette greffe n'est donc pas vitale pour le patient.
Contexte
Les reins jouent un rôle important dans le corps humain ; ils sont principalement responsables de la filtration de sang et de l’élimination des toxines qui y circulent. Le sang entre dans les reins par l’artère rénale, qui est une branche de l’aorte abdominale et sort par la veine rénale qui débouche dans la veine cave inférieure. Une fois dans les reins, le sang passe à travers les néphrons où les déchets et l'excès d'eau sont évacués. Le sang purifié retourne dans le corps par les veines rénales. Quotidiennement les reins normaux épurent une quantité de plasma avoisinant 180 litres [1]
Les déchets filtrés du sang sont ensuite concentrés pour former l'urine. L’urine est recueillie par les bassinets avant d’être acheminée vers la vessie à travers les uretères où elle est emmagasinée. L'urine est ensuite évacuée du corps par l'urètre. Les reins agissent également comme glandes endocrines en produisant des hormones ; ainsi ils jouent un rôle important dans la régulation[1] :
- l'érythropoïétine (EPO) : Elle incite la moelle osseuse à fabriquer des globules rouges en stimulant la différenciation, la prolifération et la maturation des précurseurs des hématies
- le calcitriol 1,25-dihydroxycholécalciférol : Une forme de vitamine D, qui aide le côlon à absorber le calcium
- la rénine : Elle aide à régulariser la pression artérielle.
Ces éléments font des reins des organes vitaux et nécessaires à la survie et la régulation de l’organisme. L’évaluation de la fonction rénale se mesure à sa capacité de débarrasser le sang des déchets toxiques dont la créatinine : produit de la dégradation de la créatine. En outre, l’élimination de cette substance toxique prend exclusivement la voie urinaire sans qu’elle subisse ni de la réabsorption ni de la modification au niveau des reins [1] . Cela dit que cette substance est la mieux éligible à témoigner l’état du fonctionnement rénal. En d’autre terme : une forte créatinémie atteste que les reins ont du mal à l’éliminer du fait que son évacuation à l’extérieur prend exclusivement la voie urinaire ainsi que le reste des déchets toxiques. La clairance d’une substance donnée se mesure de la façon suivante [1]
Où :
- Ux : la concentration de la substance dans l’urine en mg/ml
- DU: le débit urinaire en ml/min
- Px: la concentration de la substance dans l’urine en mg/ml
- Clairance: la clairance en ml/min
Cependant, l’application de cette formule afin de déterminer la clairance de la créatinine n’est pas aisée en raison de la difficulté de calcul du volume de la diurèse durant les 24 heures[2]. Or, en milieu pratique, la formule de Cockcroft et Gault est la plus utilisée; elle permet de mesurer la clairance en fonction de l’âge, du poids, du sexe et la créatinémie à l’aide de la formule suivante:
- : estimation de la clairance de la créatinine en mL/min ;
- : créatininémie en µmol/L ;
- Âge : âge en année ;
- Poids : masse corporelle en kg ;
- k : coefficient qui vaut 1,23 chez l'homme et 1,04 chez la femme.
Chez un sujet normal, le calcul de la clairance de la créatinine correspond au débit de la filtration glomérulaire (DFG) soit 120 ml/min. Cependant, une diminution de la clairance de la créatinine témoigne un problème de dysfonctionnement rénal. Ce dysfonctionnement résulte de la perte progressive des glomérules : unité fonctionnelle et structurale des reins[2].
L’installation de l’insuffisance rénale chronique est progressive allant du stade débutant au stade terminal quand il s’agit d’une clairance inférieure à 15 ml/min[3] La fonction rénale est donc endommagée de façon irréversible et ce contexte doit faire appel à différentes modalités de traitement. La prévalence de l’insuffisance rénale, selon les chiffres rapportés par Unites States Renal Data System[4], est de 14 % aux États-Unis[3]. Elle est en augmentation à raison de 55 000 nouveaux cas annuellement en raison de son rapport avec les maladies cardiovasculaires : HTA et le diabète dont la prévalence est de plus en plus élevée dans la société moderne[4]. Classiquement, la restauration de la fonction d’évacuation des déchets toxiques se fait à l’aide des techniques de la dialyse. Actuellement, la transplantation trouve notamment sa place à côté de la dialyse dans le traitement de l’insuffisance rénale chronique (IRC) en stade terminal [5] et des études rapportent son efficacité en termes d’espérance de vie qui s’est avérée plus prometteuses que chez les dialysés [6]. Au fil de ce rapport, on abordera les problématiques qui y sont liés à différents niveaux en essayant de les découper en unités compréhensibles et faire la synthèse des éléments constitutifs du thème.
Historique
Les premières expérimentations ont lieu sur des animaux. En 1902, le docteur Emerich Ullmann rapporte la première autotransplantation avec un succès relatif : sa transplantation de rein d'un chien au niveau de son cou reste fonctionnelle quelques jours[7].
En 1906, Mathieu Jaboulay met au point la technique de xénotransplantation rénale humaine en greffant un rein de porc puis un rein de chèvre au pli du coude de deux femmes atteintes d'insuffisance rénale. Dans les deux cas, les deux femmes meurent à cause du rejet mais malgré cet échec, il montre la faisabilité de la technique. La même année, Ernst Unger (de) greffe un rein de macaque sur une femme, sans plus de succès. En 1908, Alexis Carrel réalise la première auto-transplantation rénale parfaitement fonctionnelle sur une chienne[8].
Dans les années 1930 et 1940, le chirurgien soviétique Yuri Voronoy, conscient que les greffons d'animaux sur des hommes sont incompatibles au niveau immunologique, réalise des homogreffes sur des patients humains mais les problèmes de rejet font que les patients ne survivent que quelques jours[9]. Au début des années 1950, les greffes à partir de rein de cadavres humains ou de donneurs vivants voient quelques succès relatifs : certains patients survivent quelques mois grâce à un traitement immunosuppresseur à base d'ACTH et de cortisone[10].
La première transplantation rénale à partir d'un donneur vivant apparenté a lieu dans la nuit du 24 au sur le jeune Marius Renard par le professeur Jean Hamburger, Gabriel Richet,et l'équipe de Louis Michon à l'Hôpital Necker à Paris[11]. Malgré un traitement immunosuppresseur à base de cortisone, Le jeune homme meurt 21 jours plus tard. La première transplantation rénale en Belgique est pratiquée le à l'hôpital Brugmann par l'équipe du professeur Paul Mingers
Pré-transplantation
Le receveur
L’insuffisance rénale décrite comme étant un dysfonctionnement de la fonction rénale constitue la couche sous-jacente à l’origine de l’évolution défavorable vers le caractère chronique dont la phase terminale est l’indication directe soit à la transplantation rénale ou soit à la dialyse. Le caractère chronique de l’insuffisance rénale se définit comme étant le déclin lent et progressif de la fonction rénale résultant de la baisse de la fonction glomérulaire due à une réduction permanente du nombre de néphrons fonctionnels. La régression est traduite également par la diminution de la clairance de la créatinine et s’installe graduellement. Le stade terminal est caractérisé par une clairance <15ml/min et les reins cessent alors de fonctionner[1].
Les symptômes évocateurs du stade terminal sont divers et variés. Le tableau ci-dessous compile l’ensemble des symptômes observés chez les insuffisants rénaux en stade terminal provenant d’une revue systématique[12]. Le clinicien, par la suite, est en mesure de confirmer son diagnostic à travers le dosage de la créatinine dans le sang et le calcul de la clairance par la formule de Cockcroft et Gault mentionnée ci-dessus.
| Symptôme | Asthénie | Prurit | Constipation | Anorexie | Douleur | Anxiété | Nausée |
| Incidence | 71 % | 55 % | 53 % | 49 % | 47 % | 38 % | 33 % |
| Rang | 12-97 % | 10-57 % | 8-57 % | 25-61 % | 8-82 % | 12-58 % | 15-48 % |
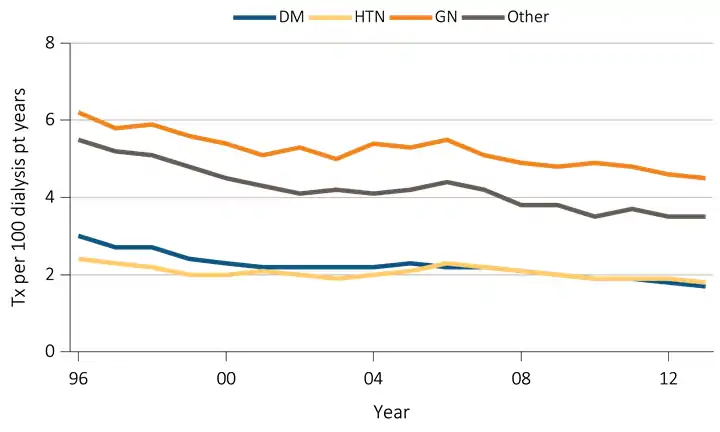
L’IRC en stade terminal peut être d’origine diverse et varie également en fonction du terrain et d’une période à une autre (figure 1). Les prévalences moyennes des étiologies observées chez les personnes atteintes de l’IRC en stade terminal rapportées par USRDS sont réparties comme suit : le diabète type-1 30 %, l’HTA 25 %, GN 15 %, Néphropathie interstitielle chronique 8 %. L’étiologie est inconnue chez 20 % des atteintes[13].
Les étiologies sous-jacentes ainsi que le tableau symptomatique servent d'éléments d’orientation vers un examen complémentaire affirmatif du diagnostic de l’IRC terminale. Le dosage de la créatinémie et le calcul de la clairance qui soit <15 ml/min en sont l’affirmation. Tout patient inscrit dans ce contexte, qu’il soit pris en charge ou non en dialyse, est un candidat potentiel à une transplantation rénale[14].
Le bilan préopératoire
La mise en place d’un programme de transplantation chez un patient nécessite un bilan biologique et morphologique exhaustif afin d’éviter toute contre-indication au geste. Les contre-indications majeures à la transplantation que rapporte la littérature sont les maladies cardiovasculaires, les cancers ainsi que les infections généralisées systémiques dont la tuberculose[15]. Or, L’examen clinique et paraclinique doit porter essentiellement sur les éléments suivants[5]:
- Cardiovasculaire : À la recherche des atteintes cardiaques au moyen des instruments d’exploration : échographie cardiaque.
- Infections : À la recherche de foyers infectieux, hépatite B/C, syphilis, tuberculose.
- Néoplasies : À la recherche des tumeurs. Chez la femme : examen gynécologique, mammographie et frottis. cervico-vaginal. Chez l’homme : Cytologie urinaire si possible
- Immunologique : Groupe sanguin, phénotype HLA, anticorps anti-HLA
- Anomalies de l’arbre urinaire : Cystographie rétrograde non systématique
Temps d’attente pour un greffon
Selon les données rapportées par United States Renal Data System (USRDS) [16], la durée d’attente est de plus en plus longue au fil des dernières années.
Cela se traduit également par une importante augmentation de l’incidence des insuffisants rénaux en stade terminal en attente d’un greffon (figure 3). Cela est justifié bien évidemment par l’incidence générale des IRC en stade final qui est en augmentation continue depuis 1998 [17]ainsi que la pénurie en organes due au déclin du nombre de donneurs [18]. Certains articles se sont penchés sur cette problématique afin d’en identifier les causes et ont conclu que la peur des complications et le manque d’information jouent un rôle important dans cette pénurie [19].

Le greffon
La transplantation implique d’avoir à sa disposition un greffon qui peut être sur un donneur vivant ou sur un donneur décédé. La littérature rapporte également que les résultats de la survie chez les greffés à partir des donneurs vivants sont significativement meilleurs que les résultats obtenus à partir des donneurs décédés. Selon Paul Terasaki[20], la survie moyenne à dix ans est de 68 %, mais elle atteint 80 % chez les patients ayant un greffon à partir d’un donneur vivant. D’autres statistiques issues d’USRDS rapportent un écart significatif en faveur des greffons issu de donneurs vivants en termes de survie. L’hypothèse a été validée à travers certaines études portantes sur des échantillons qui ne présentaient aucune histocompatibilité tant pour le greffon cadavérique que pour le donneur vivant : le cas de don entre époux. Il s’est avéré que malgré l’histocompatibilité, les receveurs ayant bénéficié d’un greffon depuis un donneur vivant (époux), ont bénéficié d’une espérance de vie meilleure. En montrant que la survie à 3 ans était observé chez 85 % chez greffon à partir de donneurs vivants contre 70 % des greffons cadavériques (données 1995).
La qualité de l’organe à transplanter fait l’objet d’une évaluation à travers les antécédents du donneur. Le donneur subit examen clinique exhaustif portant sur l’ensemble de ses appareils afin d’éviter une éventuelle contre-indication au don d’organe, notamment les maladies transmissibles. Les contre-indications qu’on peut énumérer : âge <18 ans, HTA, diabétique, antécédent d’atteinte rénale, tumeurs, cardiopathie et VIH-positif.
Histocompatibilité
Deux entités sont à l’origine de l’incompatibilité histologique suscitant la réaction immunitaire chez le receveur :
- HLA : Le gène hla code les molécules qui assurent la fonction de la présentation antigénique de l’organisme. Cette fonction de présentation de l’antigène est assurée par les molécules de CMH. Ces molécules de nature protéique sont fixées pratiquement sur les membranes de toutes les cellules de l’organisme et leur permettent d'être reconnues comme appartenant à ce même organisme.
Les cellules de l’organe greffé porteuses d’un CMH non conforme à celui de l’organisme est à l’origine de l’incompatibilité histologique pouvant susciter la réaction immunitaire de la part du receveur à l’égard de l’organe reçu et perçu comme étant un corps étranger. Ces marqueurs de type protéique sont codés au niveau du génome par un très grand nombre d’allèles générant un polymorphisme génétique au sein des individus. Or, il est impératif de procéder au test de Cross-Match afin de vérifier si le receveur a développé des anticorps spécifiques dirigés contre les cellules du donneur[21].
- ABO/Rh : Il s’agit d’une deuxième entité de l’identité biologique. Cependant, les antigènes sont fixés exclusivement sur les globules rouges du sang. Ils sont à deux types : antigènes A et antigène B. Le système ABO se définit en fonction de la présence ou non d’antigènes A ou B à la surface des globules rouges et la présence ou non d'anticorps anti-A ou anti-B dans le sérum. Le rhésus joue aussi un rôle sous cette entité antigénique liée aux globules rouges. Il est important également de prendre en considération cette entité lors de la transplantation[1].
Technique de la transplantation rénale
Elle est réalisée en plusieurs étapes. Il est important d'assurer les précautions d'asepsie nécessaires lors de la réalisation du geste. La laparoscopie est de plus en plus utilisée dans la réalisation de la transplantation que ce soit durant la phase du prélèvement rénal ou lors de son insertion[22]. Cette technique que l’on va décrire est une technique chirurgicale minimalement invasive qui consiste à introduire une caméra via l’ombilic et des instruments chirurgicaux à travers des trocarts installés en différents endroits au niveau de l’abdomen et dont le diamètre ne dépasse pas les 10 mm [23]. Le chirurgien reçoit en temps réel l’image retournée par la caméra et contrôle les instruments chirurgicaux manuellement.
Des études rapportent que la laparoscopie est plus efficace et moins coûteuse en termes de complications postopératoires comparativement à la méthode classique par voie rétro-péritonéale [24]. Son avantage majeur réside dans la capacité de malade de se rétablir rapidement après l’intervention. L’utilisation des techniques laparoscopiques diminuent la morbidité chez le donneur vivant. Cet atout est lié à la technique laparoscopie elle-même[22].
Prélèvement rénal
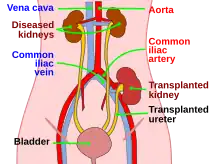
Le patient est hospitalisé et sous l'anesthésie globale. La littérature rapporte que le choix du rein gauche est préféré en raison de la longueur importante de la veine rénale gauche [25]. Le prélèvement rénal se fait en supprimant tout d’abord les adhésions avec les structures anatomiques qui y sont liées afin de libérer les reins de ses rapports. Le rein est également lié à l’organisme par son pédicule fonctionnel formé par l’ensemble des vaisseaux afférant et efférent dont : l’artère rénale qui est une branche de l’aorte abdominale, la veine rénale qui débouche dans la veine cave inférieure et l’uretère qui s'anastomose avec la vessie pour y acheminer l’urine [26]. Ensuite, après en avoir identifié la région du pédicule fonctionnel, ses éléments sont clampés au niveau de leurs afin de les occluser et empêcher la perte sanguine lors de leur dissection.
Finalement une incision de 8 cm est créée au niveau de l’hypochondre pour retirer le rein. Ensuite, le rein est mis dans une glacière à température basse au sein d’un liquide physiologique afin de conserver son intégrité structurale et fonctionnelle [26].
L’insertion rénale
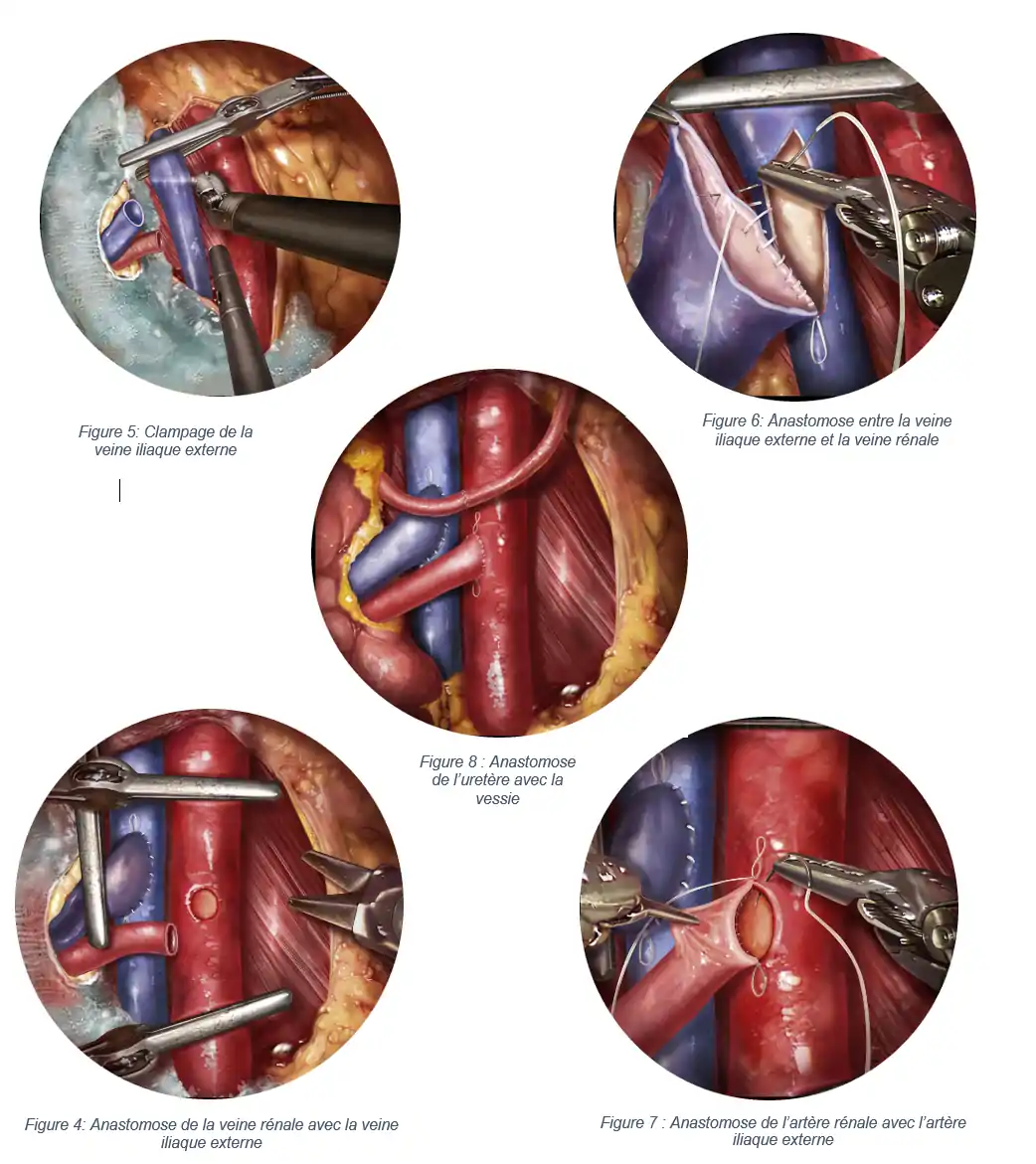
Le rein est inséré dans la fosse iliaque après la création d’une incision à ce niveau. L’insertion rénale comporte des enjeux liés à la mise en communication des vaisseaux du pédicule rénal avec ceux du receveur. La procédure de l’anastomose concerne l’artère rénale avec l’artère iliaque externe(AIE) du receveur et la veine rénale avec la veine iliaque externe (VIED) et l’uretère avec la vessie du receveur. La procédure de l’insertion se déroule en plusieurs phases [26]:
- Identification de la région d’intérêt et le clampage de l’AIE et la VIE du receveur (figure 5).
- Anastomose de la veine rénale avec la VIE du receveur (figure 4, 6)
- Anastomose de l’artère rénale avec l’AIE du receveur (figure 7)
- Anastomose de l’uretère du greffon avec la vessie du receveur (figure 8)
- Rupture du clampage
Fermeture et suture de la fosse iliaque.
Post-transplantation
Mortalité et survie chez le receveur
La transplantation trouve sa place à côté de la dialyse dans le traitement de l’insuffisance rénale en stade terminal. Cependant, il a été établi que la transplantation rénale réduit le risque de mortalité et la morbidité et améliore la qualité de vie chez le patient de façon plus importante comparativement à la dialyse [17](figure 9). Cela se traduit par un avantage majeur en faveur de la transplantation en termes de survie après l’intervention. Pour cette raison, la transplantation est qualifiée comme étant un traitement de choix pour les insuffisants en stade terminal.
La survie chez le transplanté dépend de plusieurs facteurs dont l'âge et les antécédents médicochirurgicaux ainsi que les autres atteintes médicales associées [27]. Selon une étude faite en 2003, il a été observé que la survie à 5 ans après l’intervention été recensée chez 73 % de l’ensemble des transplantés [28] : 68 % chez les transplantés âgés (>=65 ans) contre 86 % chez les jeunes (18-64 ans) ; ce qui nous a menés à conclure que l’âge est un facteur déterminant de la durée de survie chez le greffé.
La durée de vie moyenne d’un greffé rénal est passée de 7,9 ans en 1988 à plus de 14 ans aujourd’hui [29]. L’évolution est due en grande partie au développement des modalités de l’immunosuppression et les conduites préventives contre les complications postopératoires.
Cette figure illustrative compare le taux de mortalités chez les personnes dialysées et les personnes transplantées.

Risque chez le donneur vivant
Plusieurs articles s’intéressent à la problématique relative au taux de mortalité peropératoire chez le donneur en s’appuyant sur les sondages rapportés par les données d’USRDS. Les données rapportent que la mortalité a été le sort de 0,02 % des donneurs [30]. Le risque de mortalité est plus lié à la technique chirurgicale qu’à la procédure d’enlèvement rénal en raison des causes relatives aux complications de la technique même [30]. La littérature rapporte également que le donneur pourrait vivre avec un seul rein sans complications majeures et mener une vie très normale[31]. Il a été également montré que le don d’un rein n’affecte pas l'espérance de vie chez le donneur sain qui ne présente aucune contre-indication au geste [32]. Il a été conclu que le don ne présente aucunement un facteur de risque de l’insuffisance rénale. Cette hypothèse a été validée à travers la mesure du débit de la filtration glomérulaire et la surveillance de la qualité de vie chez 255 donneurs [32] ; l’étude a conclu également que le risque est le même que chez la population générale. Cependant, la complication majeure la plus redoutée et reste extrêmement rare : la compression du nerf fémoral qui a été remarquée chez 0,2 % des donneurs et l’article rapporte que le donneur peut bénéficier de la même espérance de vie que la population générale [31].
Complications postopératoires chez le receveur
Ces complications sont variées. On retrouve celles qui sont observées après toute chirurgie comme on retrouve également celles qui sont spécifiques à la transplantation. Les complications sont possibles sur le plan urologique, cardiovasculaire et immunologique [33]. Cliniquement, on distingue les complications précoces pouvant apparaitre durant le premier mois suivant la transplantation, et les complications tardives survenues au-delà de cette période. Leur gravité est liée au fait qu’elles touchent au terrain fragilisé par l’immunosuppression et l’insuffisance rénale.
Les complications précoces : on en cite : le risque de rejet aigu, hémorragie, thrombose vasculaire, hématurie, fistules urinaires, obstruction urinaire et les infections
Complications tardives : les plus fréquentes sont : la sténose urinaire et les complications cardio-vasculaires. Cependant, la complication la plus redoutable est le rejet chronique.
Prise en charge postopératoire
Immunosuppression
Avec les progrès des traitements immunosuppresseurs, la survie du greffon progresse constamment. Au début de l’histoire de la transplantation, l’immunosuppression associait l’irradiation et les corticoïdes à fortes doses [34]. Sous cette modalité, l’incidence de la mortalité dépassait largement les 50 % et la survie à 1 an avoisinait à peine les 50 % en raison des complications qui y sont liées. Actuellement, avec le développement des modalités de l’immunosuppression visant à réduire les effets secondaires via de nouvelles molécules en associant les stéroïdes-anticalcineurine-inhibiteur de l’IMPDH reste le traitement de base[15]. L’efficacité des associations de traitements immunosuppresseurs a entraîné une diminution de l’incidence du rejet aigu et donc une amélioration des succès à court terme.
Surveillance de la fonction rénale
Une étude par biopsie systématique a montré qu’à 10 ans, 100 % des greffons présentaient des lésions histologiques au niveau de l’organe greffé [35]. Cela dit, l’évolution de la fonction rénale doit retenir toute l’attention du clinicien et de son patient. La recherche de l’étiologie devant toute dégradation de la fonction du greffon est importante, afin de mettre en place un traitement quand cela est envisageable. Une insuffisance rénale aiguë doit faire rechercher les mêmes étiologies pré- ou post-rénales que chez le patient non transplanté.
Les éléments à surveiller afin d’évaluer l’évolution de la fonction rénale chez le transplanté sont le taux de la créatinine dans le sang et la protéinurie [15]. Dans les études observationnelles, la survie des patients ayant bénéficié d’une transplantation rénale est associée à un contrôle précoce et strict de la protéinurie.
Surveillance de l'HTA
L’HTA est une complication que l’on trouve chez 75 % des greffés [35]. Elle peut être secondaire au traitement immunosuppresseur et les lésions vasculaires qui fait que le greffé est exposé à un risque cardio vasculaire majeur imposant un contrôle strict et régulier de la pression artérielle ainsi que l’évaluation des facteurs de risque cardio-vasculaire dont le taux du cholestérol et la prévention hygiénique et alimentaire [29].
Surveillance d’autres complications
Tel qu'abordé dans la parties des complications postopératoires, il est important de mener un examen régulier afin de prévenir les symptômes spécifiques à chacune des complications mentionnées[29].
Limites et perspectives
Les résultats prouvant l’efficacité de la transplantation rénale ont conduit à un élargissement des indications au profit de receveurs plus difficiles (receveurs). La limite supérieure d’âge en transplantation a été régulièrement augmentée et à l’heure actuelle, l’âge ne présente aucune contre-indication au geste.
Bien que la survie chez le greffé s’est beaucoup améliorée, la littérature rapporte une stagnation dans l’évolution de la survie depuis les années 1995 [36] (figure 10).
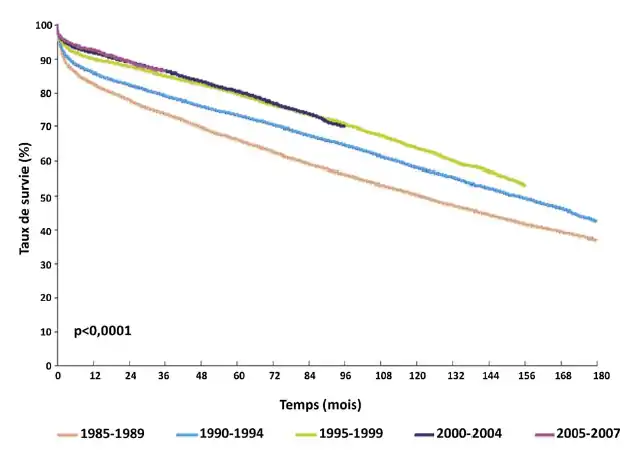
Bien que l’évolution de la survie chez les transplantés prend son origine en grande partie du développement des modalités de l’immunosuppression et la technique chirurgicale qui est de moins en moins invasive, le bénéfice à plus long terme est modeste. Ceci a plusieurs explications. Tout d’abord, les mécanismes immunologiques qui aboutissent à la destruction chronique du greffon sont moins bien compris. En outre, la néphrotoxicité des immunosuppresseurs, dont l’importance est désormais bien évaluée à long terme, entraîne une perte significative de greffons. Enfin, d’autres effets secondaires des immunosuppresseurs limitent la survie, soit des patients par le biais des complications cardiovasculaires, des infections et des cancers, soit des greffons par le biais de l’HTA, du diabète et la tuberculose [36].
Sous l’optique d’améliorer la méthode chirurgicale qui conditionne également la survie après la transplantation, s’inscrit la chirurgie rénale robotisée. C’est une nouvelle technique minimalement invasive qui se fait à l’aide des bras opérateurs manipulant les instruments de microchirurgie et un bras optique permettant une vision en deux ou trois dimensions que le chirurgien commande à partir de l’unité de contrôle [37].
À ce jour, seule une centaine de patients dans le monde (principalement en Inde et aux États-Unis, ont bénéficié d’une transplantation à l’aide d’un robot chirurgical. Cette technique apporte de nombreux avantages qui font de plus en plus l’objet d’études d’efficacité et d’impact sur la survie et la réduction du taux de la mortalité. Cependant, et vu que le nombre de patients ayant bénéficié d’une telle procédure est limité, la technique est encore dans sa phase expérimentale et ses données primaires rapportent les avantages suivants [37] :
- Diminution de la taille de la cicatrice du fait que seules cinq incisions de 8 mm ont été nécessaires pour introduire les instruments de microchirurgie.
- Atténuation de la douleur après l’intervention
- Réduction des risques de complication infectieuse postopératoire
- Diminution du temps d’hospitalisation et rétablissement après quatre jours d’hospitalisation en moyenne.
Conclusion
Bien que le délai d’attente d’un greffon s’étend de plus en plus, la transplantation rénale reste le traitement de choix de l’insuffisance rénale chronique en stade terminal en raison de son rôle majeur dans l’augmentation de l’espérance de vie chez le greffé.
Certes, le progrès qu’a connu la procédure d’immunosuppression a joué un rôle important dans la diminution du taux de mortalité. Cependant, les effets secondaires des immunosuppresseurs sont bien connus dans la littérature et présentent des complications conditionnant la mortalité chez le receveur. L’efficacité de la transplantation rénale reste multifactorielle puisqu’elle dépend de plusieurs éléments dont : l’origine du greffon, la condition du receveur et la technique chirurgicale ainsi que les conduites postopératoires préventives des complications.
En outre, survie du greffon à long terme est en stagnation depuis ces dernières années et une étude approfondie des causes mérite d’être réalisée.
Une panoplie de recherches a été menée dans le but d'augmenter la longévité des receveurs ainsi que l’amélioration de leur quotidien ; les meilleurs résultats ont été observés avec la technique robotisée qui méritent d’être validés sur un nombre plus étendu de receveurs. En revanche, l’objectif des futurs traitements immunosuppresseurs est l’induction de la tolérance de l’hôte vis-à-vis du greffon afin d’éviter les effets secondaires et la majorité des recherches entreprises en transplantation vise cet objectif puisque la transplantation rénale est le seul traitement qui permet au malade d'avoir une vie quasi-normale.
Notes et références
- Nguyen, S.H. and R. Bourouina, Manuel d'anatomie et de physiologie. 2008: Wolters Kluwer France.
- KESSLER, M., Insuffisance rénale chronique: Étiologie, physiopathologie, diagnostic, principes du traitement. La revue du praticien, 1998. 48: p. 1457-1463.
- Coresh, J., et al., Prevalence of chronic kidney disease and decreased kidney function in the adult US population: Third National Health and Nutrition Examination Survey. American journal of Kidney diseases, 2003. 41(1): p. 1-12.
- Saran, R., et al., US Renal Data System 2014 Annual Data Report: Epidemiology of Kidney Disease in the United States. American journal of kidney diseases: the official journal of the National Kidney Foundation, 2015. 65(6 Suppl 1): p. A7.
- Matignon, M., et al., Transplantation rénale: indications, résultats, limites et perspectives. La Presse Médicale, 2007. 36(12): p. 1829-1834.
- Port, F.K., et al., Comparison of survival probabilities for dialysis patients vs cadaveric renal transplant recipients. Jama, 1993. 270(11): p. 1339-1343.
- (de) Emerich Ullmann, « Experimentelle Nierentransplantation », Wiener Klinische Wochenschrift, vol. 15, , p. 281–282
- René Küss et Pierre Bourget, Une histoire illustrée de la greffe d'organes : la grande aventure du siècle, Frison-Roche, , p. 29-32
- (en) David Hamilton, A History of Organ Transplantation, University of Pittsburgh Pre, , p. 162
- Christophe Legendre, La transplantation rénale, Lavoisier, , p. 12
- René Küss et Pierre Bourget, Une histoire illustrée de la greffe d'organes. La grande aventure du siècle, Frison-Roche, , p. 44
- Murtagh, F.E., J. Addington-Hall, and I.J. Higginson, The prevalence of symptoms in end-stage renal disease: a systematic review. Advances in chronic kidney disease, 2007. 14(1): p. 82-99.
- KESSLER, M., Insuffisance rénale chronique: Étiologie, physiopathologie, diagnostic, principes du traitement. La revue du praticien, 1998. 48: p. 1457-1463.
- Matignon, M., et al., Transplantation rénale: indications, résultats, limites et perspectives. La Presse Médicale, 2007. 36(12): p. 1829-1834.
- Kälble, T., et al., EAU guidelines on renal transplantation. European urology, 2005. 47(2): p. 156-166.
- Saran, R., et al., US Renal Data System 2014 Annual Data Report: Epidemiology of Kidney Disease in the United States. American journal of kidney diseases: the official journal of the National Kidney Foundation, 2015. 65(6 Suppl 1): p. A7. http://www.usrds.org/
- Foley, R.N. and A.J. Collins, End-stage renal disease in the United States: an update from the United States Renal Data System. Journal of the American Society of Nephrology, 2007. 18(10): p. 2644-2648.
- Rodrigue, J.R., J.D. Schold, and D.A. Mandelbrot, The decline in living kidney donation in the United States: Random variation or cause for concern? Transplantation, 2013. 96(9).
- Alvaro, E., et al., Living kidney donation among Hispanics: a qualitative examination of barriers and opportunities. Progress in Transplantation, 2008. 18(4): p. 243-250.
- Terasaki, P.I., et al., High survival rates of kidney transplants from spousal and living unrelated donors. New England Journal of Medicine, 1995. 333(6): p. 333-336.
- Colombani, J., HLA: le complexe majeur de présentation et d'histocompatibilité humain. 1993: John Libbey Eurotext.
- Gill, I.S., et al., Comparative analysis of laparoscopic versus open partial nephrectomy for renal tumors in 200 patients. The Journal of urology, 2003. 170(1): p. 64-68
- Vilos, G., et al., Laparoscopic entry: a review of techniques, technologies, and complications. Journal of obstetrics and gynaecology Canada: JOGC= Journal d'obstetrique et gynecologie du Canada: JOGC, 2007. 29(5): p. 433-465
- Nanidis, T.G., et al., Laparoscopic versus open live donor nephrectomy in renal transplantation: a meta-analysis. Annals of surgery, 2008. 247(1): p. 58-70
- Kobayashi, K., et al., Interventional radiologic management of renal transplant dysfunction: indications, limitations, and technical considerations 1. Radiographics, 2007. 27(4): p. 1109-1130.
- LE CHOIX, D.G., Technique chirurgicale de la transplantation rénale. Progrès en urologie, 1996. 6: p. 594-604.
- van Walraven, C., P.C. Austin, and G. Knoll, Predicting potential survival benefit of renal transplantation in patients with chronic kidney disease. Canadian Medical Association Journal, 2010. 182(7): p. 666-672.
- Humar, A., et al., Graft and quality of life outcomes in older recipients of a kidney transplant. Experimental and clinical transplantation: official journal of the Middle East Society for Organ Transplantation, 2003. 1(2): p. 69-72.
- Frimat, L., et al., Prise en charge de la maladie rénale chronique après transplantation rénale. Néphrologie & Thérapeutique, 2009. 5: p. S293-S296.
- Matas, A.J., et al., Morbidity and mortality after living kidney donation, 1999–2001: survey of United States transplant centers. American Journal of Transplantation, 2003. 3(7): p. 830-834.
- Johnson, E.M., et al., COMPLICATIONS AND RISKS OF LIVING DONOR NEPHRECTOMY1. Transplantation, 1997. 64(8): p. 1124-1128.
- Ibrahim, H.N., et al., Long-term consequences of kidney donation. New England Journal of Medicine, 2009. 360(5): p. 459-469.
- Benoit, G. and M. Bitker, Aspects chirurgicaux de l'insuffisance rénale chronique et transplantation. Progrès en urologie, 1996. 6.
- Küss, R., Histoire de la transplantation rénale. Prog. Urol, 1996. 6: p. 677-682.
- Karam, G., et al. Complications chirurgicales de la transplantation rénale. in Annales d'urologie. 2007. Elsevier.
- Hourmant, M. and C. Garandeau, L’évolution de la transplantation rénale ces 20 dernières années. La Presse Médicale, 2011. 40(11): p. 1074-1080.
- Menon, M., et al., Robotic kidney transplantation with regional hypothermia: a step-by-step description of the Vattikuti Urology Institute–Medanta Technique (IDEAL phase 2a). European urology, 2014. 65(5): p. 991-1000.
![{\displaystyle Clairance={\frac {[Ux]\times DU}{[Px]}}}](https://img.franco.wiki/i/ba4404cd41e13df6202f3055e7619aa23e64cfeb.svg)
![{\displaystyle Cl_{Cr}={\frac {140-{\text{Âge}}}{[Cr]}}\times Poids\times k}](https://img.franco.wiki/i/fbfa4c03ff00c8d75f70d2479eb088c139464279.svg)

![{\displaystyle [Cr]}](https://img.franco.wiki/i/a95d17a6e5e614881c537ab1ea68c7f7e40508cf.svg)