Tétroxyde d'osmium
Le composé chimique tétroxyde d'osmium est un tétraoxyde d'osmium, de formule chimique OsO4, dans lequel ce dernier élément chimique est représenté à son état d'oxydation théorique le plus élevé : +8. Ce corps composé, qui peut se présenter en longs cristaux incolores à odeur forte, est très volatil et vénéneux. La couleur brun-jaune provient de la présence de dioxyde d'osmium OsO2 qui se forme très rapidement par réduction du tétroxyde de formation initiale plus aisée.
| Tétroxyde d'osmium | ||
| ||
 | ||
 |
||
| Identification | ||
|---|---|---|
| Nom UICPA | Tétroxyde d'osmium | |
| No CAS | ||
| No ECHA | 100.040.038 | |
| No CE | 244-058-7 | |
| Apparence | corps composé solide polymorphe, incolore à jaune pâle (présence de dioxyde d'osmium), d'odeur acre type chloré (oxydant) ou de pourriture organique (après oxydation)[1]. | |
| Propriétés chimiques | ||
| Formule | OsO4 | |
| Masse molaire[2] | 254,23 ± 0,03 g/mol O 25,17 %, Os 74,83 %, |
|
| Propriétés physiques | ||
| T° fusion | 42 °C[1] | |
| T° ébullition | 130 °C[1] | |
| Solubilité | dans l'eau à 25 °C : 60 g l−1[1] | |
| Masse volumique | 4,9 g cm−3[1] | |
| Pression de vapeur saturante | à 27 °C : 1,5 kPa[1] | |
| Précautions | ||
| SGH[3] | ||
  Danger |
||
| SIMDUT[4] | ||
   C, D1A, E, |
||
| Transport | ||
| Écotoxicologie | ||
| Seuil de l’odorat | bas : 0,001 9 ppm[6] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
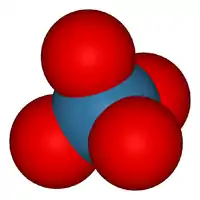
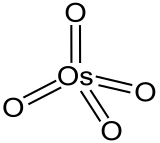
Molécule analogue au tétraoxyde de ruthénium RuO4, l'OsO4 forme un tétraèdre qui a pour centre l'atome d'osmium et pour extrémités les atomes d'oxygène reliés à l'osmium central par double liaison covalente.
Un composé oxygéné très oxydant de la chimie de l'osmium
Lorsque de l'osmium, corps simple métal, est exposé sous forme de poudre à l'air chaud, il s'oxyde lentement en tétroxyde d'osmium qui se sublime facilement à température ambiante. La réaction est importante à 200 °C et elle est rapide et totale si on chauffe au rouge vif de 400 °C à 800 °C.
- Os solide cristal chauffé, parfois jusqu'au rouge vif + 2 O2 gaz → OsO4 gaz obtenu à températures élevées
Cela donne un gaz très oxydant, extrêmement toxique et à l'odeur particulièrement forte. Cela explique le nom de l'élément, qui vient du grec osmê qui signifie « odeur ».
Il existe en réalité deux formes allotropiques du composé chimique tétraoxyde d'osmium. La plus instable fond vers 39,5 °C et la plus stable existe encore solide à 41 °C. Cette forme est très peu soluble dans l'eau à température ambiante, à peine 60 g l−1.
Le tétraoxyde d'osmium est beaucoup plus soluble dans le tétrachlorure de carbone, soit 2 500 g l−1.
La solution aqueuse de tétroxyde d'osmium laisse un solide cristallisé, l'acide osmique. L'acide osmique n'est pas une vague forme hydratée de tétroxyde d'osmium, mais simplement un autre corps chimique de formule simple H2OsO4 qui comprend deux terminaisons hydroxydes et oxydes par rapport à l'atome central d'osmium. C'est souvent ce dernier solide cristallisé plus stable, plus facilement manipulable et moins toxique, sorte de "tétraoxyde d'osmium" mis en conserve ou stabilisé, que les chimistes emploient comme agent oxydant en synthèse organique ou les biochimistes comme colorant de préparations cellulaires en microscopie[7].
Si la formation du tétraoxyde d'osmium est facile, ce dernier corps très oxydant est facilement réduit en dioxyde d'osmium OsO2 par les poussières ou les graisses, ou tous autres corps chimiques potentiellement réducteurs. Ainsi,
OsO4 gaz ou liquide + surface graisseuseorgane cellulaire → OsO2 solide à température ambiante + surface (bi)oxydéeorgane cellulaire (par O2 après destruction du complexe tétraoxyde d'Os fixé)
Toxicité
Cet oxyde volatil et très oxydant est extrêmement toxique, même en très faible quantité, et doit être manipulé avec d'importantes précautions. En particulier, l'inhalation même à des concentrations trop faibles pour en percevoir l'odeur peut entraîner des lésions graves de la peau, des yeux et des voies respiratoires, amenant à des œdèmes aux poumons, et causer la mort. Des symptômes détectables peuvent n'apparaître que plusieurs heures après l'exposition.
L'irritation des yeux est très rapide par les vapeurs, elle peut conduire à la cécité. Le corps oxydant, facilement sublimable à température ambiante et d'autant plus qu'il est chauffé, est très irritant et agressif pour les muqueuses. Ses vapeurs peuvent ronger les fosses nasales et provoquer des atteintes graves au système respiratoire à des concentrations faibles dans l'air, soit 10−7 g/cm3.
Il faut travailler sous hotte spéciale et en milieu sécurisée d'évacuation de vapeurs (procédé de réduction).
Applications
Cet oxydant puissant, qui, à faible dose, est facilement réduit par les graisses et les poussières, peut servir à détecter des empreintes digitales. Il peut servir à colorer les graisses des préparations ou coupes microscopiques au laboratoire de biologie.
Cet oxyde est un puissant colorant souvent utilisé dans la microscopie électronique en transmission (MET) pour donner du contraste à l'image. De la même manière, il peut colorer la cornée humaine, ce qui entraîne la cécité, lorsque les précautions nécessaires ne sont pas observées.
En synthèse organique, il est parfois utilisé pour oxyder les alcènes en diols, à l'instar du permanganate de potassium, utilisé dilué et à froid. C'est un agent oxydant pour la syndihydroxylation des alcènes.
Il est notamment impliqué dans la réaction catalytique appelée dihydroxylation de Sharpless, du chimiste Karl Barry Sharpless, prix Nobel de chimie 2001.
En biologie cellulaire, le tétraoxyde d'osmium est également utilisé pour colorer les saccules de la partie cis de l'appareil de Golgi. Il est aussi utilisé en histologie comme fixateur.
Risques d'emploi de guerre chimique
Le , l'agence de presse américaine ABC News rapportait que les services secrets britanniques auraient déjoué une attaque terroriste impliquant une bombe au tétroxyde d'osmium.
Histoire
Le tétraoxyde d'osmium est responsable de l'odeur nauséabonde des résidus noirs de production de platine à partir du traitement des minerais de platine américain par l'eau régale. Le chimiste anglais Smithson Tennant est un des premiers chimistes à avoir décrit ce composé inconnu en cristal filiforme et proposé le nom d'un nouvel élément osmium en 1804.
Le terme adjectival "osmique" se généralise en français dans les comptes-rendus de l'académie des sciences vers 1842.
Références
- TETROXYDE D'OSMIUM, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Tétroxyde d'osmium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Entrée du numéro CAS « 20816-12-0 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28 novembre 2008 (JavaScript nécessaire)
- « Osmium tetroxide », sur hazmap.nlm.nih.gov (consulté le )
- Fiche de sécurité CNESST québécois
