Syndrome de Wolff-Parkinson-White
Le syndrome de Wolff-Parkinson-White (WPW) est un trouble rare du rythme cardiaque secondaire à un syndrome de préexcitation électrique ventriculaire. Il est dû à la présence anormale d'une voie de conduction appelée faisceau de Kent.
| Médicament | Adénosine et lidocaïne |
|---|---|
| Spécialité | Cardiologie |
| CIM-10 | I45.6 |
|---|---|
| CIM-9 | 426.7 |
| OMIM | 194200 |
| DiseasesDB | 14186 |
| MedlinePlus | 000151 |
| eMedicine |
159222 med/2417 |
| MeSH | D014927 |
| MeSH | C14.280.067.780.977 |
| Patient UK | Wolff-Parkinson-White-Syndrome |
![]() Mise en garde médicale
Mise en garde médicale
Ce syndrome, responsable de tachycardie supraventriculaire paroxystique, se diagnostique par électrocardiogramme. Certaines formes peuvent se compliquer d'une mort subite.
Historique
Stanley Kent décrit dès 1893 des voies de connexion entre les ventricules et les oreillettes situées sur leur paroi latérale mais croit qu'il s'agit d'une situation physiologique[1]. Ces voies reçurent plus tard son nom. Le syndrome est décrit en 1930 par les médecins Wolff, Parkinson et White[2] - [3] mais des cas isolés ont été auparavant publiés dès 1915[4]. Ce n'est qu'en 1943 qu'est fait le rapprochement entre le syndrome et la voie accessoire[5]. Sa complication, la mort subite par fibrillation ventriculaire, a été suspectée dès 1971[6].
Les premières études électrophysiologiques chez l'humain de ce syndrome datent de la fin des années 1960, établissant le mode de début et de fin des tachycardies paroxystiques ainsi que le circuit de réentrée[7] - [8].
Le traitement consistait initialement en une section chirurgicale de la voie accessoire dont le premier succès a été décrit en 1968[9]. dans les années 1980, il y a eu plusieurs tentatives de section du faisceau de Kent par voie endocavitaire, d'abord par choc électrique à haute énergie[10], puis par radiofréquence à la fin de ces mêmes années[11].
Physiologie
Chez les individus sains, l'activité électrique du cœur est initiée au niveau du nœud sinusal (localisé à la jonction entre la veine cave supérieure et l'oreillette droite). L'onde de dépolarisation se propage alors vers le nœud atrioventriculaire (situé à la partie basse de l'oreillette droite), puis vers les ventricules cardiaques par l'intermédiaire du faisceau de His.
Le nœud atrioventriculaire agit comme une « barrière », limitant l'activité électrique qui atteint les ventricules cardiaques. Cette fonction est essentielle car si le signal électrique généré au niveau des oreillettes s'accroît (comme c'est le cas au cours de la fibrillation auriculaire ou du flutter), le nœud atrioventriculaire va limiter l'activité électrique qui sera conduite aux ventricules.
Par exemple, si les oreillettes sont électriquement activées à 300 battements par minute, environ la moitié des impulsions électriques seront bloquées par le nœud atrioventriculaire ; ainsi, les ventricules seront activés à environ 150 battements par minute (donnant ainsi une fréquence cardiaque de 150 par minute).
Une autre fonction importante du nœud atrioventriculaire est de pouvoir ralentir les impulsions électriques. Cela se traduit sur l'électrocardiogramme par l'espace PR, qui correspond au temps séparant l'activation des oreillettes (onde P) et l'activation des ventricules cardiaques (complexe QRS).
Physiopathologie
Les individus présentant un syndrome de Wolff-Parkinson-White possèdent une voie de conduction atrio-ventriculaire supplémentaire, appelée « faisceau de Kent ». Cette voie accessoire correspond à une communication électrique anormale entre les oreillettes et les ventricules cardiaques.
Cette voie accessoire va, dans certaines circonstances, « court-circuiter » le nœud atrioventriculaire, aboutissant à une dépolarisation prématurée du ventricule, visible sous forme d'« ondes delta » sur l'électrocardiogramme. Cette voie ne partage pas les propriétés du nœud atrioventriculairee. Elles peuvent ainsi n'être perméables que dans un seul sens. Certaines voies sont, par ailleurs, très perméables au niveau conduction électrique, ne jouant pas le rôle de filtre du nœud atrioventriculaire. En cas de tachycardie atriale rapide, par exemple lors d'une fibrillation atriale, le ventricule peut être stimulée à une fréquence très importante avec un risque de passage en fibrillation ventriculaire pouvant être responsable d'une mort subite. Cette situation est facilitée en cas d'administration de digitaliques ou d'inhibiteurs calciques.
La localisation de la voie accessoire est, dans 60% des cas, du côté de l'anneau mitral (voie gauche), dans 15% au niveau de l'anneau tricuspide sur sa paroi latérale et dans 25 % au niveau du septum[12]. La détermination de cette localisation peut être fait par l'analyse de l'onde delta ou au cours d'une exploration électrophysiologique. Ces voies peuvent être multiples.
D'autres types de faisceaux accessoires peuvent exister :
- connexion directe entre l'oreillette et le faisceau de His (intervalle PR court, sans ondes delta) : syndrome de Lown-Ganong-Levine ;
- faisceau connectant le faisceau de His (ou une de ses branches) directement avec le myocarde.
Causes
La cause de la présence de la voie accessoire est inconnue dans environ 95 % des cas. Elle se voit fréquemment en cas de malformation d'Ebstein, comportant une malposition de l'anneau tricuspide et qui doit être recherché à titre systématique chez les porteurs d'un Wolff-Parkinson-White.
Il est décrit des formes familiales et deux gènes ont été identifiés dont les mutations provoquent le syndrome : PRKG2[13] et BMP2[14].
Le syndrome de Wolff-Parkinson-White est parfois associé à la neuropathie optique de Leber[15] - [16], une maladie génétique liée à une atteinte de l'ADN mitochondrial.
Épidémiologie
Son incidence est difficile à préciser car un certain nombre de syndromes de Wolff-Parkinson-White ne sont pas diagnostiqués et les signes électrocardiographiques peuvent être transitoires. Lors de bilans systématiques, cette dernière a été retrouvée chez 2.5/1000 sujets[17].
Les hommes sont plus fréquemment atteints que les femmes. Ce syndrome peut toucher toutes les tranches d'âges mais se rencontre plus fréquemment chez l'enfant et l'adulte jeune[18].
La mort subite chez les personnes atteintes du syndrome WPW est rare (incidence inférieure à 0,6 %) et est généralement causée par la propagation d'une tachycardie auriculaire vers les ventricules par le faisceau de Kent[19] - [20].
Diagnostic
Clinique
Environ la moitié des sujets restent asymptomatiques tout au long de leur vie[21].
Dans le cas contraire, il peut se manifester par des crises de tachycardie paroxystique de type Bouveret. Il peut également entraîner des syncopes ou une mort subite par fibrillation auriculaire compliquée de fibrillation ventriculaire.
Électrocardiogramme
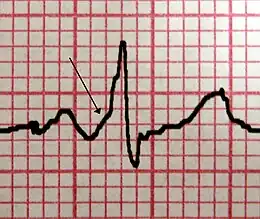
Lorsque le rythme est sinusal (rythme cardiaque normal), on retrouve un aspect caractéristique de ce syndrome : les ondes delta : la pente au début de la branche montante de l’onde R n’est pas aussi raide que normalement. Après quelques centièmes de seconde, la pente redevient normale. Cette onde delta, qui est surajoutée avant et pendant la phase initiale de l’onde R, entraîne un raccourcissement de l’intervalle PR et un allongement de la durée du complexe QRS (élargissement des complexes QRS), ainsi que des troubles de la repolarisation.
Cet aspect caractéristique est dû au fait que chez les sujets atteints d'un syndrome de Wolff-Parkinson-White, l'activité électrique initiée au niveau du nœud sinusal est propagée non seulement via le nœud atrioventriculaire mais conjointement par la voie accessoire. Cette seconde voie ne possédant pas les propriétés du nœud atrioventriculaire (voir Physiopathologie), l'impulsion électrique active les ventricules en premier par la voie accessoire, et immédiatement après par la voie normale : ce qui explique l'espace PR court et l'onde delta.
En cas de fibrillation auriculaire, le syndrome peut être suspecté en raison de la fréquence ventriculaire particulièrement rapide, pouvant dépasser les 200 par minute avec des complexes QRS élargis et variables.
L'électrocardiogramme peut être parfois normal, l'onde delta n'étant que transitoire, soit en raison d'une période réfractaire longue de la voie accessoire, soit par conduction cachée.
Autres examens
Un test à l'effort permet de voir si l'aspect de l'onde delta persiste ou non avec l'augmentation de la fréquence cardiaque induite à l'effort.
Une exploration électrophysiologique peut être faite, soit par voie endocavitaire, par introduction de sondes à l'intérieur du cœur sous contrôle radiologique, ou par voie trans-œsophagienne[22], par introduction d'une sonde dans l'œsophage permettant de stimuler l'oreillette gauche à travers sa paroi. Le but essentiel est de déterminer la période réfractaire de la voie accessoire, qui, si elle est basse, comporte un risque de complications graves à long terme. Cette période réfractaire est calculée par stimulation de l'oreillette à fréquence croissante, jusqu'à disparition de l'aspect de l'onde delta sur l'électrocardiogramme se surface, et par calcul de la fréquence cardiaque maximale en fibrillation auriculaire, cette dernière étant provoquée par une salve de stimulation rapide.
Prise en charge
La prise en charge des syndromes de Wolff-Parkinson-White a fait l'objet de la publication de recommandations. Celles, américaines, datent de 2015[23]. Celles, européennes, datent de 2019[12].
Évaluation du risque
La décision de traiter ou non un sujet présentant un syndrome de Wolff-Parkinson-White est prise après avoir évalué pour chaque individu le risque de mort subite. Celle-ci survient par un trouble du rythme ventriculaire sur un accès de fibrillation auriculaire. Son incidence annuelle est globalement d'environ un peu plus d'un cas pour 1 000[24], mais des chiffres allant jusqu'à 5 pour mille ont été cités[25]. Le risque est faible chez la personne asymptomatique, de l'ordre d'une mort subite par an pour 1 000 patients[26].
Un bon interrogatoire doit être réalisé à la recherche d'épisodes inexpliqués de syncope ou de palpitations, pouvant alors être dus à des épisodes précoces de tachycardie en rapport avec la voie accessoire. Le caractère asymptomatique du syndrome n'est pas forcément un critère de bénignité, la mort subite pouvant être la première manifestation de la maladie[27].
Les personnes présentant un syndrome de Wolff-Parkinson-White et dont les ondes delta disparaissent avec l'augmentation du rythme cardiaque (par exemple à l'effort) sont à faible risque de mort subite[28]. La disparition de l'onde delta montre que la voie accessoire ne peut conduire des impulsions électriques à un rythme rapide.
On considère qu'il existe un haut risque de mort subite lorsque la période réfractaire de la voie accessoire est courte[29] (mais la spécificité de ce test serait faible[30] avec une très faible valeur prédictive positive et une forte valeur prédictive négative[31]), lorsqu'il existe plusieurs voies accessoires, en cas de localisation septale[32] ou droite de la voie accessoire[33].
Les individus présentant n'importe laquelle de ces caractéristiques doivent être traités.
Traitement
Les sujets présentant une tachyarythmie mal tolérée doivent bénéficier d'une défibrillation.
Le traitement radical du syndrome de Wolff-Parkinson-White est la destruction de la voie accessoire par radiofréquence ; c'est le traitement de référence et de première intention chez le patient symptomatique depuis le début des années 1990[34]. L'ablation par radiofréquence est proposé aux sujets présentant un syndrome de Wolff-Parkinson-White symptomatique malgré le traitement médicamenteux et ceux qui sont considérés comme « à risque » de mort subite[35]. Si l'ablation par radiofréquence de la voie accessoire est réalisée avec succès, le sujet est parfois considéré comme guéri[36] - [37]. L'âge optimal pour proposer ce type de traitement n'est pas clairement établi, mais cette procédure peut être faite chez un enfant jeune.
L'activité physique, même de haut niveau, n'est pas déconseillée si le sujet est considéré comme à bas risque de mort subite[38].
Notes et références
- (en) AFS Kent « Researches on the structure and function of the mammalian heart » J Physiol. 1893;14:233
- (en) Scheinman MM, « History of Wolff-Parkinson-White syndrome » Pacing Clin Electrophysiol. 2005;28:152-156
- (en) Wolff L, Parkinson J, White PD. « Bundle-branch block with short P-R interval in healthy young people prone to paroxysmal tachycardia » Am Heart J. 1930;5:685–704
- (en) FN Wilson « A case in which the vagus influenced the form of the ventricular complex of the electrocardiogram » Arch Intern Med. 1915;16:1008–1027
- (en)Wood FC, Wolferth CC, Geckeler GD. « Histologic demonstration of accessory muscular connections between auricle and ventricle in a case of short P-R interval and prolonged QRS complex » Am Heart J. 1943;25:454–462
- (en)Dreifus LS, Haiat R, Watanabe Y, Arriaga J, Reitman N. « Ventricular fibrillation: a possible mechanism of sudden death in patients and Wolff-Parkinson-White syndrome » Circulation 1971;43:520–527
- (en)Durrer D, Schoo L, Schuilenburg RM et al. « The role of premature beats in the initiation and the termination of supraventricular tachycardia in the Wolff-Parkinson-White syndrome » Circulation 1967;36:644–662
- (en)Wellens HJ, Schuilenburg RM, Durrer D. « Electrical stimulation of the heart in patients with Wolff-Parkinson-White syndrome, type A » Circulation 1971;43:99–114
- (en)Cobb FR, Blumenschein SD, Sealy WC et al. « Successful surgical interruption of the bundle of Kent in a patient with Wolff-Parkinson-White syndrome » Circulation 1968;38:1018–1029
- (en)Fisher JD, Brodman R, Kim SG et al. « Attempted nonsurgical electrical ablation of accessory pathways via the coronary sinus in the Wolff-Parkinson-White syndrome » J Am Coll Cardiol. 1984;4:685–694
- (en)Borggrefe M, Budde T, Podczeck A et al. « High frequency alternating current ablation of an accessory pathway in humans » J Am Coll Cardiol. 1987;10:576–582
- Brugada J, Katritsis DG, Arbelo et al. 2019 ESC Guidelines for the management of patients with supraventricular tachycardia The Task Force for the management of patients with supraventricular tachycardia of the European Society of Cardiology (ESC): Developed in collaboration with the Association for European Paediatric and Congenital Cardiology (AEPC), Eur Heart J, 2020;41:655-720
- (en)Gollob MH, Green MS, Tang AS et al. « Identification of a gene responsable for familial Wolff-Parkinson-White syndrome » N Engl J Med. 2001;344:1823-1831
- (en)Lalani SR, Thakuria JV, Cox GF et al. « 20p12.3 Microdeletion predisposes to Wolff-Parkinson-White syndrome with variable neurocognitive deficits » J Med Genet. 2009;46:168–175
- (en)Nikoskelainen EK, Savontaus ML, Huoponen K, Antila K, Hartiala J. « Pre-excitation syndrome in Leber's hereditary optic neuropathy » Lancet 1994;344:857-8
- (en)Mashima Y, Kigasawa K, Hasegawa H, Tani M, Oguchi Y. « High incidence of pre-excitation syndrome in Japanese families with Leber's hereditary optic neuropathy » Clinical Genetics 1996;50:535-7.
- Krahn AD, Manfreda J, Tate RB, Mathewson FL, Cuddy T, The natural history of electrocardiographic preexcitation in men: the Manitoba Follow-up Study, Ann Intern Med, 1992;116:456–460
- Lu CW, Wu MH, Chen HC, Kao FY, Huang SK, Epidemiological profile of Wolff-Parkinson-White syndrome in a general population younger than 50 years of age in an era of radiofrequency catheter ablation, Int J Cardiol, 2014;174:530-4
- T.M. Munger, D.L. Packer, S.C. Hammill, B.J. Feldman, K.R. Bailey KR, D.J. Ballard, D.R. Jr Holmes et B.J. Gersh, « A population study of the natural history of Wolff–Parkinson–White syndrome in Olmsted County, Minnesota, 1953–1989 », Circulation, vol. 87, no 3, , p. 866–73 (PMID 8443907, DOI 10.1161/01.CIR.87.3.866)
- Fitzsimmons PJ, McWhirter PD, Peterson DW, Kruyer WB, « The natural history of Wolff–Parkinson–White syndrome in 228 military aviators: a long-term follow-up of 22 years », American Heart Journal, vol. 142, no 3, , p. 530–6 (PMID 11526369, DOI 10.1067/mhj.2001.117779, lire en ligne)
- (en)Goudevenos JA, Katsouras CS, Graekas G et al. « Ventricular pre-excitation in the general population: a study on the mode of presentation and clinical course » Heart 2000;83:29–34
- Brembilla-Perrot B. Ghawi R. Dechaux J.P. « Caractéristiques électrophysiologiques des syndromes de Wolff-Parkinson-White asymptomatiques » Arch Mal Cœur Vaiss. 1991;84:1549-54.
- Page RL, Joglar JA, Caldwell MA et al. 2015 ACC/AHA/HRS Guideline for the Management of Adult Patients With Supraventricular Tachycardia: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society, Circulation, 2016;133:e506-e574
- (en)Munger TM, Packer DL, Hammill SC et al. « A population study of the natural history of Wolff-Parkinson-White syndrome in Olmsted County, Minnesota, 1953-1989 » Circulation 1993;87:866–73
- (en)Pappone C, Santinelli V, Rosanio S et al. « Usefulness of invasive electrophysiologic testing to stratify the risk of arrhythmic events in asymptomatic patients with Wolff-Parkinson-White pattern: results from a large prospective long-term follow-up study » J Am Coll Cardiol. 2003;41:239–44
- (en)Obeyesekere MN, Leong-Sit P, Massel D et al. « Risk of arrhythmia and sudden death in patients with asymptomatic preexcitation: a meta-analysis » Circulation 2012;125:2308-2315
- (en)Timmermans C, Smeets JL, Rodriguez LM et al. « Aborted sudden death in the Wolff-Parkinson-White syndrome » Am J Cardiol. 1995;76:492–4
- (en)Wellens HJ, Pappone C, Santinelli V, « When to perform catheter ablation in asymptomatic patients with a Wolff-Parkinson-White electrocardiogram » Circulation 2005;112:2201-2216
- (en)Bromberg BI, Lindsay BD, Cain ME, Cox JL, « Impact of clinical history and electrophysiologic characterization of accessory pathways on management strategies to reduce sudden death among children with Wolff-Parkinson-White syndrome » J Am Coll Cardiol. 1996;27:690–695
- (en)Gaita F, Giustetto C, Riccardi R, Mangiardi L, Brusca A. « Stress and pharmacologic tests as methods to identify patients with Wolff-Parkinson-White syndrome at risk of sudden death » Am J Cardiol. 1989;64:487–90.
- (en)Pappone C, Vicedomini G, Manguso F et al. « Risk of malignant arrhythmias in initially symptomatic patients with Wolff-Parkinson-White syndrome: results of a prospective long-term electrophysiological follow-up study » Circulation 2012;125:661–668
- (en)Timmermans C, Smeets JL, Rodriguez LM, Vrouchos G, Van den Dool A, Wellens HJ, « Aborted sudden death in the Wolff-Parkinson-White syndrome » Am J Cardiol 1995;76:492–494
- (en)Harahsheh A, Du W, Singh H, Karpawich PP, « Risk factors for atrioventricular tachycardia degenerating to atrial flutter/fibrillation in the young with Wolff-Parkinson-White » Pacing Clin Electrophysiol. 2008;31:1307–1312
- Joseph E. Marine « L'ablation par cathéter endocavitaire dans le traitement des arythmies supraventriculaires » JAMA-français 2007;298(23):2768-80.
- (en)Triedman J, Perry J, Van Hare G. « Risk stratification for prophylactic ablation in asymptomatic Wolff-Parkinson-White syndrome » N Engl J Med. 2005;352:92-93
- (en)Pappone C, Santinelli V, Manguso F et al. « A randomized study of prophylactic catheter ablation in asymptomatic patients with the Wolff-Parkinson-White syndrome » N Engl J Med. 2003;349:1803-11.
- (en)Antz M, Weiss C, Volkmer M et al. « Risk of sudden death after successful accessory atrioventricular pathway ablation in resuscitated patients with Wolff-Parkinson-White syndrome » J Cardiovasc Electrophysiol. 2002;13:231–6.
- (en)Zipes DP, Ackerman MJ, Estes NA et al. « Task Force 7: arrhythmias » J Am Coll Cardiol. 2005;45:1354–63
- Ressources relatives à la santé :
- Orphanet
- (en) Diseases Ontology
- (en) DiseasesDB
- (en + es) Genetic and Rare Diseases Information Center
- (en) Héritage mendélien chez l'humain
- (en) Héritage mendélien chez l'humain
- (en) Medical Subject Headings
- (en + es) MedlinePlus
- (en) NCI Thesaurus