Sulfure de manganèse(II)
Le sulfure de manganèse(II) est le composé chimique de formule MnS. On peut le trouver à l'état naturel dans l'alabandite.
| Sulfure de manganèse(II) | ||

| ||
 | ||
| __ Mn2+ __ S2− | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Sulfure de manganèse(II) | |
| No CAS | ||
| No ECHA | 100.038.711 | |
| No CE | 242-599-3 | |
| PubChem | ||
| Apparence | Poudre rouge, verte ou brune | |
| Propriétés chimiques | ||
| Formule | MnS | |
| Masse molaire[1] | 87,003 ± 0,005 g/mol Mn 63,15 %, S 36,86 %, 87,004 |
|
| Propriétés physiques | ||
| T° fusion | 1 610 °C | |
| Solubilité | 0,0047 g/100 mL (18 °C) | |
| Masse volumique | 3,99 g·cm-3 | |
| Cristallographie | ||
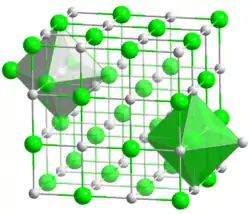
| Système cristallin | Halite (cubique) | |
| Classe cristalline ou groupe d’espace | Fm3m, No. 225 | |
| Structure type | Octahèdre (Mn2+); octahèdre (S2−) | |
| Précautions | ||
| SGH | ||
 Attention |
||
| Directive 67/548/EEC | ||
 Xi |
||
| Inhalation | Masque à poussière | |
| Peau | Gants | |
| Yeux | Lunettes | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Réactions chimiques
Le sulfure de manganèse(II) peut être obtenu en faisant réagir un sel de manganèse(II) (comme du chlorure de manganèse(II)) avec du sulfure d'ammonium :
- (NH4)2S + MnCl2 → 2 NH4Cl + MnS
Sa couleur, lorsque ce composé est obtenu par précipitation en solution aqueuse, est rose cuisse de nymphe émue.
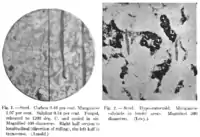
Inclusions de sulfure de manganèse (gris clair) dans de l'acier.
En métallurgie du fer, ce sulfure est le résultat de la réaction du manganèse avec le soufre. Le manganèse y est utilisé comme produit désulfurant de l'acier : le soufre (libre ou sous la forme de sulfure de fer(II)) se combine avec le manganèse pour donner du MnS, moins nocif vis-à-vis des propriétés mécaniques de l'acier, selon les réactions suivantes :
- Mn + S → MnS
- Mn + FeS → Fe + MnS
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
Cet article est issu de wikipedia. Text licence: CC BY-SA 4.0, Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.