Spiramycine
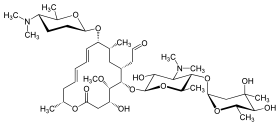
La spiramycine est un antibiotique et un antibactérien, de la classe des macrolides, composée d'un cycle central à 16 atomes. Elle est produite par la bactérie Streptomyces ambofaciens (actinomycètes).
| Spiramycine | |
| |
| Identification | |
|---|---|
| Nom UICPA | (4R,5S,6R,7R,9R,10R,11E,13E,16R)-10-{[(2R,5S,6R)-5-(dimethylamino)-6-methyltetrahydro-2H-pyran-2-yl]oxy
}-9,16-dimethyl-5-methoxy-2-oxo-7-(2-oxoethyl)oxacyclohexadeca-11,13-dien-6-yl 3,6-dideoxy-4-O-(2,6-dideoxy-3-C-methyl-α-L-ribo-hexopyranosyl)-3-(dimethylamino)-α-D-glucopyranoside
|
| Synonymes |
2-[(4R,5S,6S,7R,9R,10R,11E,13E,16R)-6-{[(2S,3R,4R,5S,6R)-5-{[(2S,5S,6S)-4,5-dihydroxy-4,6-dimethyloxan-2-yl]oxy}-4-(dimethylamino)-3-hydroxy-6-methyloxan-2-yl]oxy}-10-{[(2R,5S,6R)-5-(dimethylamino)-6-methyloxan-2-yl]oxy}-4-hydroxy-5-methoxy-9,16-dimethyl-2-oxo-1-oxacyclohexadeca-11,13-dien-7-yl]acetaldehyde
|
| No CAS | |
| No ECHA | 100.029.476 |
| Code ATC | J01 |
| PubChem | 5284619 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C43H74N2O14 [Isomères] |
| Masse molaire[1] | 843,052 7 ± 0,044 2 g/mol C 61,26 %, H 8,85 %, N 3,32 %, O 26,57 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Historique
La spiramycine a été décrite en 1954 par Pinnert-Sindico, Ninet, Preud’Homme et Cosar[2]. Cette molécule a été isolée en 1951 à partir d’une bactérie qui était jusqu’à présent inconnue, Streptomyces ambofaciens[3]. Cette bactérie provenait d'une culture prélevée de la région de Péronne (Somme, Nord-Pas-De-Calais-Picardie) en France[4]. La spiramycine présente un spectre bactérien proche de ceux de l’érythromycine, de l’oléandomycine et de la carbomycine (macrolides).
Deux ans plus tard, des chercheurs suisses, Corbaz, Ettlinger et leur équipe, ont décrit un nouvel antibiotique qu’ils ont nommé foromacidine[3].
En comparant les structures de la spiramycine et de la foromacidine, il s'est avéré qu’il s’agissait de la même molécule[3].
François, en 1955[5], et Michel, en 1958 ont montré que la spiramycine inhibe la désamination de divers acides aminés par le microbiote intestinal du porc (propriété retrouvée pour nombre d'antibiotiques). Ils ont établi une corrélation entre stimulation de croissance in vivo et action inhibitrice sur le catabolisme de l’arginine in vitro. Selon leurs travaux, la spiramycine a le taux le plus élevé d’inhibition parmi tous les antibiotiques (taux d'inhibition de 114 % ayant pour référence l’auréomycine)[6].
En , des chercheurs ont mis en évidence l’action de la spiramycine sur la croissance du porc, ce qui a confirmé les résultats in vivo de François et Michel[6].
En 1959, Conrad, Nelson et Beeson et en 1960, Hays et Speer, ont mis en évidence l’efficacité de la spiramycine, dans l'alimentation du porc, au niveau de la croissance et de l'indice de consommation[6].
En 1955, la spiramycine administrée par voie orale fut appelée « Rovamycine » par la société Rhône-Poulenc Rorer. L'activité de la spiramycine contre le parasite Toxoplasma gondii, qui est un agent de la toxoplasmose, a été révélée en 1958. Ce n’est que dix ans plus tard, qu’a débuté le traitement de la toxoplasmose chez les femmes enceintes. La production de la spiramycine pour la voie d'administration parentérale a commencé en 1987[7].
Olukoshi et Packter[8] ont émis l'hypothèse en 1994 que des réserves lipidiques (triglycérides) seraient une source de précurseurs pour la biosynthèse des antibiotiques. Par la suite, Schauner et leur équipe[9] ont mis en évidence en 1999 l’importance des lipides intracellulaires sur la production de spiramycine.
Synthèse
Il existe deux souches de bactéries Streptomyces ambofaciens ATCC23877 et DSM40697 capables de synthétiser la spiramycine.
Les plasmides jouent un rôle important lors de la biosynthèse des macrolides (Omura et coll. 1979).
Les groupements de la spiramycine
La spiramycine se compose de plusieurs groupements :
- Forosamine
- Aglycone
- Mycaminose
- Mycarose
Biosynthèse des macrolides
La biosynthèse des macrolides s'effectue en trois étapes :
- Formation de l'aglycone
- Biosynthèse des sucres
- Réactions terminales (avec attachement des sucres et de fines modifications des intermédiaires du macrolide).
Partie aglycone :
- Condensation de petites molécules (acétate, propionate et butyrate)
Synthèse de sucres :
- D-glucose est un précurseur essentiel
- Étapes de transformations : pas connues
- Rôle essentiel dans l’action de l'antibiotique
Réactions terminales :
- Formation des liaisons glycosidiques entre aglycone et dérivés de sucres
- Réactions d’oxydations sur le cycle lactonique (aglycone)
Organisation et expression des gènes de biosynthèse
Il existe deux types de gènes de biosynthèse : les gènes régulateurs pléiotropes dont la fonction est la différenciation morphologique et physiologique, et les gènes régulateurs spécifiques dont la fonction est de contrôler spécifiquement les gènes de biosynthèse.
En faisant une analyse RT-PCR de tous les gènes de biosynthèse de spiramycine, l’expression des gènes srmR et smrS a été analysée. Ceci a permis de montrer que le gène srmR (gène régulateur spécifique) est nécessaire à l’expression de srmS. Quant au gène srmS, il contrôle l’expression de la plupart des gènes de biosynthèse.
Chez S. ambofaciens, les gènes de biosynthèse (srmG), le gène de résistance (srmB) et le gène de régulation spécifique (srmR) sont dans la même région chromosomique. Les gènes, smS et srmR, sont regroupés sur un chromosome sous la forme de « clusters » ou de groupes de gènes.
L’inactivation de ces gènes conduit à la production de la spiramycine, la surpression quant à elle augmente par trois fois la production de spiramycine.
Régulation de la biosynthèse par les constituants du milieu
Les gènes de biosynthèse des enzymes du métabolisme primaire peuvent être inhibés ou réprimés par la composition du milieu. Les précurseurs servant à la synthèse de la spiramycine sont des substrats venant du métabolisme primaire.
La composition du milieu de culture
La spiramycine est composée de trois constituants aux propriétés très similaires, les spiramycines I, II et III qui sont produits à partir d'une culture de Streptomyces ambofaciens. La croissance et la production sont régies par l'absence ou la présence de certains éléments ainsi que leurs variations dans le milieu de culture, afin d'augmenter le rendement. Les premières cultures de spiramycine par les S. ambofaciens ont été réalisées sur un milieu complexe contenant des sources de carbone assimilables et certains sels minéraux, ainsi que de la farine de soja, des extraits ou autolysats de levure … Mais ces substances sont variables et complexes, ce qui entraîne des difficultés à reproduire avec précision les résultats obtenus. Aussi, les chercheurs ont mis en place un milieu de culture utilisant des substances simples pour produire des concentrations en spiramycine de plus en plus élevées. Ainsi les constituants indispensables à la production de spiramycine sont :
- Une source de carbone comme des glucides ;
- Une source d'azote sous forme de sel d'ammonium c'est-à-dire tout sel minéral ou organique dont le cation ne gêne pas le développement du micro-organisme ainsi que sa production d'antibiotique (chlorure, sulfate, nitrate, phosphate…) ;
- Certains constituants minéraux comme le chlorure, le phosphate, le carbonate de sodium, du magnésium, du zinc, du cobalt et des cations.
La source de carbone utilisée peut être sous différentes formes :
- De monosaccharides comme le glucose, le mannose et le galactose ;
- De polysaccharides comme le maltose, la dextrine, l'amidon (d'une concentration optimale de 35 à 45 g/l) et le glycogène ;
- Sous formes d'alcools de sucre comme le glycérol et le mannitol ;
- Sous forme de saccharides de concentration comprise entre 20 et 100 g/l ;
- Et des lipides sous formes d'huiles végétales et animales.
Les ions chlorure et les ions sulfate sont utilisés pour une concentration optimale en azote comprise entre 1,2 et 1,4 g/l. L'ion chlorure est aussi indispensable pour la production et la croissance de la spiramycine dont la concentration optimale est de 10 à 14 g/l, et qui est souvent introduit sous forme de chlorure de sodium ou de potassium.
Il a aussi été montré que les ions phosphate jouent plus un rôle chimique qu'un rôle tampon dans la production de spiramycine et que la concentration en phosphate détermine la répartition des trois constituants de la spiramycine ainsi que sa production. Cette concentration est optimale entre 2 et 4 g/l pour le phosphate de potassium. D'autres formes de phosphate existent comme le pyrophosphate, les métaphosphates, les polyphosphates ainsi que les glycérophosphates.
Le magnésium est quant à lui aussi présent sous forme de sulfate et de chlorure pour une concentration optimale de 1 g/l.
Sachant que la culture de Streptomyces ambofaciens devient souvent acide, il faut utiliser du carbonate de sodium de concentration optimale de 5 à 10 g/l pour éviter l'acidification et avoir une production rapide et élevée de spiramycine.
Il a aussi été prouvé que certains métaux comme le zinc (10 à 20 mg/l) et le cobalt (0,1 mg/l) sous forme de sel ionisant le métal (nitrate, chlorure, sulfate…) permettent une augmentation du rendement. L'adjonction commune de ces deux métaux a un effet synergique, le rendement étant plus élevé que lorsqu'ils sont introduits seuls. Les autres métaux utilisés seuls (sans être associés au zinc ou au nickel) capables de changer les proportions des trois constituants sont : le fer (1 à 10 mg/l), le nickel et le manganèse (0,02 à 0,2 mg/l). D'autres métaux sous forme ionique comme le cuivre, le molybdène et la vanadium agissent sur la rapidité du développement de Streptomyces. Ainsi un milieu comportant tous ces éléments simples est moins coûteux et peut être contrôlé plus facilement.
En conclusion la concentration en spiramycine I dans le produit final peut être augmentée ou diminuée en modifiant la composition du milieu en sels d'ammonium, en métaux associés à un phosphate ainsi qu'en carbonate de calcium. Par exemple, les concentrations en sels d'ammonium supérieures ou inférieures à la concentration optimale favorisent la production de spiramycine I mais diminuent le rendement global. De plus, l'augmentation de la concentration en carbonate de sodium augmente la production de spiramycine I alors que la concentration en phosphate de potassium a pour effet de la diminuer.
Les principales régulations
Les principales régulations se font par le catabolisme de source carbonée, par les acides gras, par les sources azotées et enfin par le phosphate.
En forte concentration de glucose ou d’autres sources carbonées, la production de spiramycine est défavorable. Mais elle est favorable si ces précurseurs sont faiblement métabolisés (intervention des amylases exocellulaires).
La stimulation de la bactérie par des acides gras peut conduire à une modification de la membrane cellulaire (au niveau lipidique), ce qui favorise l'assimilation d’autres précurseurs comme les sources azotées.
Une trop forte concentration en ammonium ou en composés azotés conduit à une métabolisation rapide et supprime ainsi la biosynthèse de la spiramycine. Les ions ammonium répriment les gènes de la biosynthèse d’enzymes, ce qui favorise la dégradation des acides aminés et ainsi, la synthèse de la spiramycine.
En forte concentration de phosphate, la synthèse de spiramycine est inhibée. Le phosphate agit directement sur la biosynthèse des enzymes du métabolisme secondaire. Il permet aussi le contrôle d’adénylates intracellulaires (AMP, ADP et ATP).
Autres régulations
S. ambofaciens doit assimiler de l'ammonium et du phosphate pour avoir un bon fonctionnement.
La présence d'enzymes d’activation d'acide gras à courtes chaînes est essentielle pour aboutir aux précurseurs limitants, qui sont indispensables pour la synthèse de la spiramycine.
Les trois voies aboutissant aux précurseurs limitants
Le catabolisme d'acide gras à longues chaînes ou à courtes chaînes carbonées (béta-oxydation) et la glycolyse donneront des acides gras activés.
Le catabolisme d'acides aminés (valine, isoleucine et leucine) donnera d'autres précurseurs limitants (Propionyl-CoA (3C), n-Butyrate (4C), Acetyl-CoA (2C), n-Butyl-CoA (4C)).
Mécanismes de résistance des souches productrices
La bactérie possède un mécanisme de résistance face à la spiramycine. Les gènes de biosynthèse et les gènes de résistance, se situant au même loci, sont simultanément transcrits, ce qui assure la protection de la bactérie lors de la production de la spiramycine.
La résistance peut agir sur la perméabilité membranaire ou pour certains gènes codant des protéines de transport favorisant l’excrétion de la spiramycine.
La bactérie peut aussi synthétiser des enzymes qui inactivent la production de spiramycine (par phosphorylation, acétylation, adénylation ou glycosylation).
Milieu de production de la spiramycine
Le milieu de production est un milieu liquide contenant des sous-produits de l'industrie agroalimentaire.
Milieu de production à pH = 7,7
| Corn steep | 20,0 g.L−1 |
| Amidon soluble | 50,0 g.L-1 |
| (NH4)2SO4 | 5,0 g.L-1 |
| KH2PO4 | 2,8 g.L-1 |
| FeSO4 | 0,5 g.L-1 |
| NaCl | 10,0 g.L-1 |
| Huile de maïs | 20,0 g.L-1 |
Dans ce milieu de production, Streptomyces ambofaciens peut prendre 2 formes :
- Un mycélium dense si les filaments sont libres ;
- Des pelotes si les filaments ne restent pas libres.
La production industrielle est réalisée par lots (ou « batch ») dans des fermenteurs de plusieurs dizaines de m3. Une agitation importante du milieu est essentielle pour obtenir une concentration en oxygène dissous suffisante.
Deux types d'agitation différents sont utilisés pour la culture de Streptomyces ambofaciens : l'agitation à écoulement radial et l'agitation à écoulement axial.
Mode d'action
La spiramycine inhibe la synthèse protéique bactérienne par fixation au ribosome bactérien.
Spécialités contenant de la spiramycine
- Rovamycine : c'est un parasitostatique utilisé dans la toxoplasmose chez la femme enceinte qui a eu une séroconversion au cours de la grossesse. Ca va contrôler la bactérie (antiprolifératif) mais sans la tuer. Si à l'échographie ou au DPN on remarque une anomalie, c'est que ce traitement n'est pas assez efficace, on le remplacera par un traitement réellement antitoxoplasmique.
- Rodogyl et Bi-Rodogyl (en association avec du métronidazole)
Comme additif alimentaire
La spiramycine est aussi un additif alimentaire, répertorié sous le numéro E710, pouvant être utilisé sur permission exceptionnelle pour lutter contre certaines moisissures[10] dans des produits d'origine animale.
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Pinnert-Sindico S, Ninet L, Preud'homme J et Cosar C, « A new antibiotic-spiramycin », Antibiotics Annual, 1954-1955, p. 724-727
- (en) Tadeusz Korzybski, Zuzanna Kowszyk-Gindifer et Wlodzimierz Kurylowicz, Antibiotics : Origin, Nature and Properties, Elsevier, , 1164 p. (ISBN 978-1-4832-2305-6, lire en ligne)
- « Thèse: BIOSYNTHESE DE LA SPIRAMYCINE PAR Streptomyces ambofaciens (Mohamed LAAKEL) »
- François C., Michel M. et Lemoigne M., « Action de la pénicilline et de l’auréomycine sur les propriétés désaminantes de la flore intestinale du porc. », Comptes-rendus de l'académie des sciences, no 240, , p. 124-126
- « EFFICACITE ́ DE LA SPIRAMYCINE POUR LA CROISSANCE DU POUSSIN. INFLUENCE DE LA DOSE DE L’ANTIBIOTIQUE ET DE LA NATURE DU RE ́GIME DE BASE (C. Calet, C. Roussel, J. Baratou) »
- « Présentation de la spiramycine »
- E. R. Olukoshi et N. M. Packter, « Importance of stored triacylglycerols in Streptomyces: possible carbon source for antibiotics », Microbiology (Reading, England), vol. 140 (Pt 4), , p. 931–943 (ISSN 1350-0872, PMID 8012610, DOI 10.1099/00221287-140-4-931, lire en ligne, consulté le )
- Catherine Schauner, Annie Dary, Ahmed Lebrihi et Pierre Leblond, « Modulation of Lipid Metabolism and Spiramycin Biosynthesis in Streptomyces ambofaciens Unstable Mutants », Applied and Environmental Microbiology, vol. 65, , p. 2730–2737 (ISSN 0099-2240, PMID 10347068, PMCID 91403, lire en ligne, consulté le )
- Fiche sur food-info.net