Rétromère
Le rétromère est un complexe de protéines qui joue un rôle important dans le recyclage des récepteurs transmembranaires des endosomes vers le réseau trans-Golgi (TGN)[1] - [2] - [3].
Contexte
Le rétromère est un complexe hétéropentamérique qui, chez l'homme, est composé d'un dimère moins défini de nexine de tri associé à la membrane (contenant les protéines SNX1, SNX2, SNX5, SNX6) et d'un trimère de tri des protéines vacuolaire (Vps) contenant Vps26, Vps29, Vps35. Bien que le dimère SNX soit requis pour le recrutement du rétromère dans la membrane endosomale, la fonction de liaison du chargement de ce complexe est apportée via le trimère central par la liaison de la sous-unité Vps35 à diverses molécules du chargement[4] dont M6PR[5], wntless[6] et la sortiline[7]. Une des premières études sur le tri des hydrolases acides telles que la carboxypeptidase Y (CPY) chez les mutants de la levure S. cerevisiae a conduit à l'identification de rétromères dans la médiation du trafic rétrograde du récepteur pro-CPY (Vps10) des endosomes vers le TGN[8].
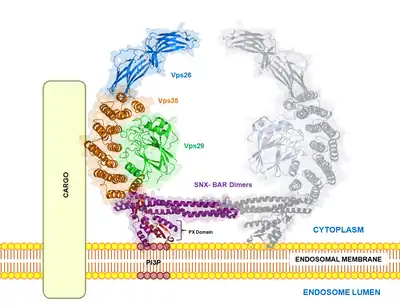
Structure
Le complexe rétromère est hautement conservé : des homologues ont été trouvés chez le nématode C. elegans, la souris et l'humain. Le complexe rétromère est constitué de 5 protéines chez la levure : Vps35p, Vps26p, Vps29p, Vps17p et Vps5p. Le rétromère des mammifères est composé de Vps26, Vps29, Vps35, SNX1 et SNX2, et éventuellement SNX5 et SNX6[9]. On pense qu'il agit via deux sous-complexes : le complexe de reconnaissance du chargement composé de Vps35, Vps29 et Vps26 (trimère Vps), et le complexe de dimères SNX-BAR qui sont constitués de SNX1 ou SNX2 + SNX5 ou SNX6 qui facilitent le remodelage et la courbure de la membrane endosomale, entraînant la formation de tubules ou vésicules qui transportent les molécules de chargement vers le réseau trans-Golgi (TGN).
Fonction
Il a été démontré que le complexe rétromère sert de médiateur à la récupération de divers récepteurs transmembranaires, tels que le récepteur au mannose-6-phosphate indépendant des cations, l'équivalent mammifère fonctionnel de Vps10 ainsi que le récepteur des Wnt, Wntless[10]. Le rétromère est nécessaire pour le recyclage de Kex2p et DPAP-A qui circulent également entre le réseau trans-Golgi et un compartiment pré-vacuolaire (équivalent de l'endosome) chez la levure. Il est également nécessaire pour le recyclage du récepteur de surface cellulaire CED-1, qui est requis pour la phagocytose des cellules apoptotiques[11].
Le rétromère joue un rôle central dans la récupération de plusieurs protéines de chargement différentes depuis l'endosome vers le réseau trans-Golgi. Cependant, il est clair qu'il existe d'autres complexes et protéines qui agissent dans ce processus de récupération. Jusqu'à présent, on ne sait pas si d'autres composants qui ont été identifiés dans la voie de récupération agissent avec un rétromère dans la même voie ou sont impliqués dans des voies alternatives. Des études récentes ont montré des défauts de tri des rétromères dans la maladie d'Alzheimer[12] - [13] et la maladie de Parkinson d'apparition tardive[14].
Le rétromère semble également jouer un rôle dans la réplication du virus de l'hépatite C[15].
Trafic rétrograde médié par le rétromère
L'association du complexe Vps35-Vps29-Vps26 aux domaines cytosoliques des membranes endosomales des molécules de chargement déclenche l'activation du trafic rétrograde et de la capture du chargement[16]. Le complexe de nucléation se forme par l'interaction du complexe VPS avec Rab7 activée par GTP[17] avec la clathrine, les adaptateurs de clathrine et diverses protéines de liaison[18].
Le dimère SNX-BAR pénètre dans le complexe de nucléation par liaison directe ou mouvement latéral sur la surface endosomale. L'augmentation du niveau de rétromère SNX-BARs provoque un basculement conformationnel vers un mode induisant une courbure qui initie la formation de tubules membranaires[19] - [20]. Une fois que les transporteurs de chargement sont arrivés à maturité, la scission des transporteurs est ensuite catalysée par la dynamine-II ou l'EHD1[21], de concert avec les forces mécaniques générées par la polymérisation de l'actine et l'activité motrice.
Le transporteur de chargement est transporté vers le TGN par des protéines motrices telles que la dynéine. L'attachement du transporteur de chargement au compartiment-destinataire provoque le décrochage du transporteur qui est médié par l'hydrolyse de l'ATP et du complexe Rab7-GTP. Une fois libérés du transporteur, le complexe Vps35-Vps29-Vps26 et les dimères SNX-BAR sont recyclés sur les membranes endosomales.
Voir aussi
Notes
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Retromer » (voir la liste des auteurs).
Références
- « Retromer: a master conductor of endosome sorting », Cold Spring Harbor Perspectives in Biology, vol. 6, no 2, , a016774 (PMID 24492709, PMCID 3941235, DOI 10.1101/cshperspect.a016774)
- « Recycle your receptors with retromer », Trends in Cell Biology, vol. 15, no 2, , p. 68–75 (PMID 15695093, DOI 10.1016/j.tcb.2004.12.004)
- « Membrane transport: retromer to the rescue », Current Biology, vol. 11, no 3, , R109–11 (PMID 11231171, DOI 10.1016/S0960-9822(01)00042-2)
- « Cargo-selective endosomal sorting for retrieval to the Golgi requires retromer », The Journal of Cell Biology, vol. 165, no 1, , p. 111–22 (PMID 15078902, PMCID 2172078, DOI 10.1083/jcb.200312034)
- « Role of the mammalian retromer in sorting of the cation-independent mannose 6-phosphate receptor », The Journal of Cell Biology, vol. 165, no 1, , p. 123–33 (PMID 15078903, PMCID 2172094, DOI 10.1083/jcb.200312055)
- « The retromer complex influences Wnt secretion by recycling wntless from endosomes to the trans-Golgi network », Developmental Cell, vol. 14, no 1, , p. 120–31 (PMID 18160348, DOI 10.1016/j.devcel.2007.12.003)
- « Sortilin mediates the lysosomal targeting of cathepsins D and H », Biochemical and Biophysical Research Communications, vol. 373, no 2, , p. 292–7 (PMID 18559255, DOI 10.1016/j.bbrc.2008.06.021)
- « A membrane coat complex essential for endosome-to-Golgi retrograde transport in yeast », The Journal of Cell Biology, vol. 142, no 3, , p. 665–81 (PMID 9700157, PMCID 2148169, DOI 10.1083/jcb.142.3.665)
- « A loss-of-function screen reveals SNX5 and SNX6 as potential components of the mammalian retromer », Journal of Cell Science, vol. 120, no Pt 1, , p. 45–54 (PMID 17148574, DOI 10.1242/jcs.03302)
- « Retromer retrieves wntless », Developmental Cell, vol. 14, no 1, , p. 4–6 (PMID 18194646, DOI 10.1016/j.devcel.2007.12.014)
- « Retromer is required for apoptotic cell clearance by phagocytic receptor recycling », Science, vol. 327, no 5970, , p. 1261–4 (PMID 20133524, DOI 10.1126/science.1184840)
- « Cargo trafficking in Alzheimer's disease: the possible role of retromer », Neurological Sciences, vol. 37, no 1, , p. 17–22 (PMID 26482054, DOI 10.1007/s10072-015-2399-3)
- « Retromer deficiency observed in Alzheimer's disease causes hippocampal dysfunction, neurodegeneration, and Abeta accumulation », Proceedings of the National Academy of Sciences of the United States of America, vol. 105, no 20, , p. 7327–32 (PMID 18480253, PMCID 2386077, DOI 10.1073/pnas.0802545105)
- « A mutation in VPS35, encoding a subunit of the retromer complex, causes late-onset Parkinson disease », American Journal of Human Genetics, vol. 89, no 1, , p. 168–75 (PMID 21763483, PMCID 3135812, DOI 10.1016/j.ajhg.2011.06.008)
- « A role for retromer in hepatitis C virus replication », Cellular and Molecular Life Sciences, vol. 73, no 4, , p. 869–81 (PMID 26298293, DOI 10.1007/s00018-015-2027-7)
- « Sorting of yeast membrane proteins into an endosome-to-Golgi pathway involves direct interaction of their cytosolic domains with Vps35p », The Journal of Cell Biology, vol. 151, no 2, , p. 297–310 (PMID 11038177, PMCID 2192648, DOI 10.1083/jcb.151.2.297)
- « Regulation of retromer recruitment to endosomes by sequential action of Rab5 and Rab7 », The Journal of Cell Biology, vol. 183, no 3, , p. 513–26 (PMID 18981234, PMCID 2575791, DOI 10.1083/jcb.200804048)
- « Recent advances in retromer biology », Traffic, vol. 12, no 8, , p. 963–71 (PMID 21463457, DOI 10.1111/j.1600-0854.2011.01201.x)
- « Curved EFC/F-BAR-domain dimers are joined end to end into a filament for membrane invagination in endocytosis », Cell, vol. 129, no 4, , p. 761–72 (PMID 17512409, DOI 10.1016/j.cell.2007.03.040)
- « Amphipathic motifs in BAR domains are essential for membrane curvature sensing », The EMBO Journal, vol. 28, no 21, , p. 3303–14 (PMID 19816406, PMCID 2776096, DOI 10.1038/emboj.2009.261)
- « Major histocompatibility complex class II-peptide complexes internalize using a clathrin- and dynamin-independent endocytosis pathway », The Journal of Biological Chemistry, vol. 283, no 21, , p. 14717–27 (PMID 18378669, PMCID 2386912, DOI 10.1074/jbc.M801070200)