Rétigabine
La rétigabine ou ezogabine est le principe actif d'un médicament antiépileptique développé par les sociétés Valeant Pharmaceuticals et GlaxoSmithKline. Elle a été approuvée par la Food and Drug Administration (FDA), sous le nom de Potiga, le et par l'Agence européenne des médicaments sous le nom de Trobalt le .
| Rétigabine | ||
| ||
 | ||
| Rétigabine | ||
| Identification | ||
|---|---|---|
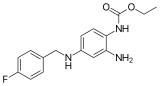
| Nom UICPA | éthyl N-[2-amino-4-[(4-fluorophényl)méthylamino]phényl]carbamate | |
| Synonymes |
Ezogabine |
|
| No CAS | ||
| No ECHA | 100.158.123 | |
| Code ATC | ||
| PubChem | 121892 | |
| SMILES | ||
| Propriétés chimiques | ||
| Formule | C16H18FN3O2 [Isomères] |
|
| Masse molaire[1] | 303,331 4 ± 0,015 3 g/mol C 63,35 %, H 5,98 %, F 6,26 %, N 13,85 %, O 10,55 %, |
|
| Données pharmacocinétiques | ||
| Liaison protéique | 60–80% | |
| Métabolisme | Hépatique par glucuronidation and acétylation. | |
| Demi-vie d’élim. | 8 h (moyenne) soit de 7 à 11 h[2] | |
| Excrétion |
rénale (84%) |
|
| Considérations thérapeutiques | ||
| Classe thérapeutique | Anti-épileptique | |
| Voie d’administration | orale | |
| Grossesse | Non recommandé | |
| Conduite automobile | Information recommandée | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Indications
La rétigabine est limitée au traitement des crises d’épilepsie partielles résistantes, avec ou sans généralisation secondaire, chez les patients épileptiques âgés de 18 ans et plus, en association, lorsque les autres associations médicamenteuses appropriées se sont révélées inadéquates ou n’ont pas été tolérées[3].
Mode d'action
Des études in vitro indiquent que la rétigabine agit essentiellement par l'ouverture des canaux potassiques neuronaux (KCNQ2 [Kv7.2] et KCNQ3 [Kv7.3])[4].
Ce mécanisme d'action est unique parmi les médicaments antiépileptiques et peut-être prometteur pour le traitement d'autres affections neurologiques, y compris la migraine[5], et certaines névralgies.
Effets indésirables
Des données de pharmacovigilance rapportant des cas de modifications pigmentaires des tissus oculaires, incluant la rétine, ainsi que de la peau, des lèvres et/ou des ongles ont conduit à une restriction d’indication de la rétigabine[3].
Fin de la commercialisation
En 2017, GSK annonce sa décision, à partir de juin de cette année, de cesser la commercialisation du Trobalt , en raison de son utilisation très limitée et de la baisse continue du nombre de patients traités. Cette décision est vivement regrettée par la communauté médicale, car pour un certain nombre de malades, il n'existe aucune alternative médicamenteuse. Un dernier espoir est que la molécule soit reprise par un laboratoire spécialisé dans les médicaments destinés aux maladies orphelines[6].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en)G.M. Ferron et al., « Multiple-dose, linear, dose-proportional pharmacokinetics of retigabine in healthy volunteers », Journal of clinical pharmacology, vol. 42, no 2, , p. 175-182 (PMID 11831540, lire en ligne [html], consulté le )
- Synthèses d'avis et fiches bon usage, Haute Autorité de santé, France,
- (en)M.A. Rogawski, C.W. Bazil, « New molecular targets for antiepileptic drugs: alpha(2)delta, SV2A, and K(v)7/KCNQ/M potassium channels », Current neurology and neuroscience reports, vol. 8, no 4, , p. 345-352 (PMID 18590620, lire en ligne [html], consulté le )
- (en) Shuang Li, Veronica Choi, Thanos Tzounopoulos, « Pathogenic plasticity of Kv7. 2/3 channel activity is essential for the induction of tinnitus », Proceedings of the National Academy of Sciences, vol. 110, no 24, , p. 9980-9985 (lire en ligne).
- Trobalt, l'antiépileptique qui rendait les gens bleus
Voir aussi
Bibliographie
- Rétigabine sur le site de l'Agence fédérale des médicaments et des produits de santé (Belgique)
Articles connexes
- KCNK3, une protéine constituante d'un canal potassique à deux pores.