Réaction de Stork
La réaction de Stork est une réaction chimique comportant une addition d'une énamine sur un accepteur de Michael — un composé carbonylé α,β-insaturé par exemple — ou un autre réactif d'alkylation électrophile pour donner un iminium alkylé, hydrolysé par la suite sous l'effet d'un acide dilué en solution aqueuse pour donner une cétone ou un aldéhyde alkylé[1]. Elle tire son nom de Gilbert Stork, chimiste américain d'origine belge. Les énamines étant généralement produites à partir de cétones et d'aldéhydes, ce procédé, également appelé alkylation des énamines de Stork, permet de réaliser des monoalkylations de cétones ou d'aldéhydes, ce qu'il est difficile de réaliser directement. Il se déroule en trois temps : formation d'une énamine à partir d'une cétone, puis addition de l'énamine à la cétone ou à l'aldéhyde α,β-insaturé, et enfin hydrolyse de l'énamine pour former une cétone :
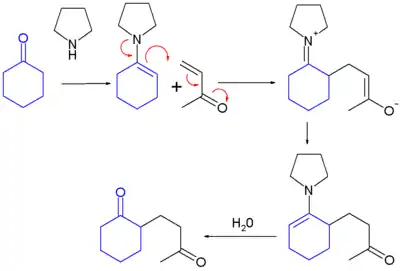
Cette réaction s'applique aux halogénures d'acyle comme électrophiles, ce qui conduit à la formation de 1,3-dicétones (acylation de Stork)[2].
Elle est également efficace sur les alkyles électrophiles activés sp3 comme les halogénures d'alkyles benzyliques, allyliques/propargyliques, α-carbonyles (tels que la bromacétone CH3C(O)CH2Br) et α-alcoolates. Cependant, des halogénures d'alkyle non activés, comme les halogénures de méthyle et d'autres alkyles primaires, ne donnent généralement que de faibles rendements du produit d'alkylation recherché[3].
Variations
L'utilisation d'une version anionique d'énamine, un azaénolate ou une métalloénamine, permet d'alkyler des cétones ou des aldéhydes avec des halocarbures comme électrophiles moins réactifs[4] (par exemple ci-dessous avec du bromure de benzyle C6H5CH2Br) :
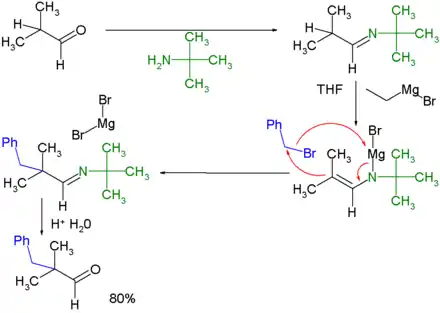
Par cette méthode, un composé carbonylé est converti en imine par une réaction de substitution avec une amine primaire. L'imine réagit ensuite avec un réactif de Grignard (dans l'exemple ci-dessus, le bromure d'éthylmagnésium CH3CH2MgBr) pour donner l'azaénolate de magnésium correspondant. La charge négative de cette espèce lui permet de déplacer un anion halogénure des halogénoalcanes moins réactifs, tels que les halogénures de méthyle, d'éthyle et d'autres composés non activés. L'hydrolyse donne là encore une cétone alkylée.
Notes et références
- (en) John McMurry, Organic Chemistry, 6e éd., Thomson-Brooks/Cole, 2003. (ISBN 0-534-38999-6)
- (en) Jerry March, Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 3e éd., Wiley, 1985. (ISBN 0-471-85472-7)
- (en) Gilbert Stork, A. Brizzolara, H. Landesman, J. Szmuszkovicz et R. Terrell, « The Enamine Alkylation and Acylation of Carbonyl Compounds », Journal of the American Chemical Society, vol. 85, no 2, , p. 207-222 (DOI 10.1021/ja00885a021, lire en ligne)
- (en) Gilbert Stork et Susan R. Dowd, « A New Method for the Alkylation of Ketones and Aldehydes: the C-Alkylation of the Magnesium Salts of N-Substituted Imines », Journal of the American Chemical Society, vol. 85, no 14, , p. 2178-2180 (DOI 10.1021/ja00897a040, lire en ligne)