Réaction de Pictet-Spengler
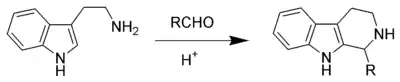
La réaction de Pictet-Spengler est une réaction chimique dans laquelle une β-aryléthylamine comme la tryptamine réalise une fermeture de cycle après une condensation avec un composé carbonylé. Classiquement, on utilise une catalyse acide et le milieu réactionnel est chauffé[1] - [2], mais certains composés donnent de bons rendements même dans des conditions physiologiques[3]. La réaction de Pictet-Spengler peut-être considérée comme un cas particulier de la réaction de Mannich.
La réaction a été découverte en 1911 par Amé Pictet et Theodor Spengler. Elle reste une réaction importante dans le domaine de la synthèse des alcaloïdes et des produits pharmaceutiques.
Les composés aromatiques nucléophiles comme les indoles ou les pyrroles donnent de bons rendements avec des conditions douces, tandis que les composés aromatiques moins nucléophiles comme les phényles donnent des rendements faibles, même sous hautes températures et en utilisant un acide fort. La réaction historique de Pictet-Spengler est la réaction de la β-phényléthylamine avec le diméthylacétal du formaldéhyde et de l'acide chlorhydrique formant une tétrahydroisoquinoléine.
La réaction de Pictet-Spengler a été appliquée en chimie combinatoire sur phase solide avec succès[4] - [5].
Une réaction analogue utilisant un aryl-β-éthanol est appelée « réaction d'Oxa-Pictet-Spengler ».
Mécanisme réactionnel
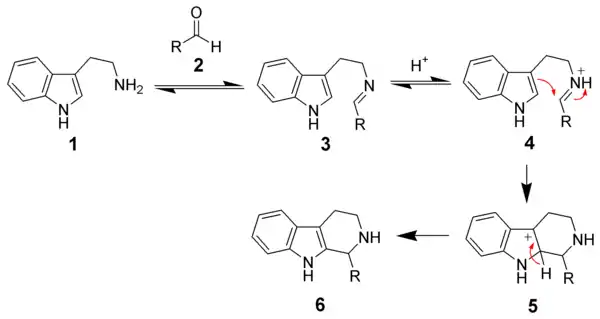
La force motrice de la cyclisation est l'électrophilie de la double liaison de l'imine[6]. Le mécanisme passe par la formation d'un ion iminium (4) suivie d'une substitution électrophile en position 2. Le produit désiré (6) est obtenu après déprotonation. Cette réaction est un exemple de réaction 6-endo-trig qui est favorisé par les règles de Baldwin.
Variantes
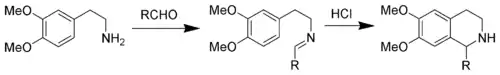
Synthèse de Pictet-Spengler des tétrahydroisoquinoléines
Utiliser un 3,4-diméthoxypényle à la place de l'indole revient à effectuer la synthèse des tétrahydroisoquinoléine de Pictet-Spengler. Les conditions de réactions sont généralement plus dures que dans la variante utilisant des indoles et nécessitent l'utilisation d'acides forts comme l'acide chlorhydrique, l'acide trifluoroacétique ou les superacides et de fortes températures[7].
Réaction de Pictet-Spengler via un N-acyliminium
À la place de la catalyse par un acide fort de la cyclisation de Pictet-Spengler, il est possible d'acyler l'ion iminium pour former un intermédiaire N-acyliminium. L'ion N-acyliminium est un électrophile extrêmement puissant et la plupart des systèmes aromatiques peuvent être cyclisés sous des conditions douces avec de bons rendements[8].
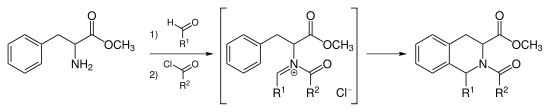
Le Tadalafil est synthétisé en utilisant cette réaction[9] qui peut aussi être catalysée par AuCl3 et AgOTf[10].
Réaction asymétrique de Pictet-Spengler
La réaction de Pictet-Spengler peut créer un nouveau centre chiral. Plusieurs variantes diastéréosélectives ont été développées, contrôlées par le substrat ou à l'aide d'auxiliaire chiraux[11] - [12] - [13], ou grâce à un acide de Lewis chiral[14].
Références
- (de) A. Pictet et T. Spengler, « Über die Bildung von Isochinolin-derivaten durch Einwirkung von Methylal auf Phenyl-äthylamin, Phenyl-alanin und Tyrosin », Ber. Dtsch. Chem. Ges., vol. 44, no 3, , p. 2030-2036 (ISSN 0365-9496, DOI 10.1002/cber.19110440309).
- (en) W. M. Whaley et T. R. Govindachari, Organic Reactions, vol. 6, John Wiley & Sons, , 528 p. (ISBN 978-0-471-00627-5, DOI 10.1002/0471264180.or006.03), chap. 3 (« The Pictet-Spengler Synthesis of Tetrahydroisoquinolines and Related Compounds »).
- (de) G. Hahn et H. Ludewig, « Synthese von Tetrahydro-harman-Derivaten unter physiologischen Bedingungen, I. (vorläuf.) Mitteil », Ber. Dtsch. Chem. Ges., vol. 67, no 12, , p. 2031-2035 (ISSN 0365-9496, DOI 10.1002/cber.19340671221).
- (en) T. E. Nielsen, F. Diness et al., « The Pictet-Spengler reaction in solid-phase combinatorial chemistry », Curr. Opin. Drug Discov. Devel., vol. 6, no 6, , p. 801–814 (PMID 14758752).
- (en) T. E. Nielsen et M. Meldal, « Solid-Phase Synthesis of Pyrroloisoquinolines via the Intramolecular N-Acyliminium Pictet−Spengler Reaction », J. Comb. Chem., vol. 7, no 4, , p. 599-610 (ISSN 1520-4766, DOI 10.1021/cc050008a).
- (en) E. D. Cox et J. M. Cox, « The Pictet-Spengler condensation: a new direction for an old reaction », Chem. Rev., vol. 95, no 6, , p. 1797-1842 (ISSN 0009-2665, DOI 10.1021/cr00038a004).
- (en) A. Yokoyama, T. Ohwada et al., « Prototype Pictet−Spengler Reactions Catalyzed by Superacids. Involvement of Dicationic Superelectrophiles », J. Org. Chem., vol. 64, no 2, , p. 611-617 (ISSN 0022-3263, DOI 10.1021/jo982019e).
- (en) B. E. Maryanoff, H.-C.. Zhang et al., « Cyclizations of N-Acyliminium Ions », Chem. Rev., vol. 104, no 3, , p. 1431-1628 (ISSN 0009-2665, DOI 10.1021/cr0306182).
- (en) D. Bonnet et A. Ganesan, « Solid-Phase Synthesis of Tetrahydro-β-carbolinehydantoins via the N-Acyliminium Pictet−Spengler Reaction and Cyclative Cleavage », J. Comb. Chem., vol. 4, no 6, , p. 546-548 (ISSN 1520-4766, DOI 10.1021/cc020026h).
- (en) S. W. Youn, « Development of the Pictet−Spengler Reaction Catalyzed by AuCl3/AgOTf », J. Org. Chem., vol. 71, no 6, , p. 2521-2523 (ISSN 0022-3263, DOI 10.1021/jo0524775).
- (en) C. Gremmen, B. Willemse et al., « Enantiopure Tetrahydro-β-carbolines via Pictet−Spengler Reactions with N-Sulfinyl Tryptamines », Org. Lett., vol. 2, no 13, , p. 1955-1958 (ISSN 1523-7060, DOI 10.1021/ol006034t).
- (en) E. L. Larghi, M. Amongero et al., « The intermolecular Pictet-Spengler condensation with chiral carbonyl derivatives in the stereoselective syntheses of optically-active isoquinoline and indole alkaloids », ARKIVOC, no 12, , p. 98-153 (ISSN 1551-7004, lire en ligne).
- (en) J. L. Vicario (dir.) et T. S. Kaufman, New Methods for the Asymmetric Synthesis of Nitrogen Heterocycles, Trivandrum, Inde, Research Signpost, , 295 p. (présentation en ligne), chap. 4 (« Synthesis of Optically-Active Isoquinoline and Indole Alkaloids Employing the Pictet-Spengler Condensation with Removable Chiral Auxiliaries Bound to Nitrogen »), p. 99-147.
- J. Seayad, A. M. Seayad et al., « Catalytic Asymmetric Pictet−Spengler Reaction », J. Am. Chem. Soc., vol. 128, no 4, , p. 1086-1087 (ISSN 0002-7863, DOI 10.1021/ja057444l).
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Pictet–Spengler reaction » (voir la liste des auteurs).
Voir aussi
- Réaction de Bischler-Napieralski