Ptérine
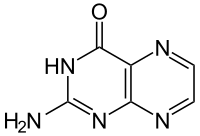
La ptérine (du grec pteron, aile) est un composé hétérocyclique constitué d'un noyau de pyrazine fusionné avec un noyau de pyrimidine (une ptéridine donc), avec sur le carbone 4 de la pyrimidine, un groupe carbonyle, et sur le carbone 2 un groupe amine. Il existe plusieurs tautomères de la ptérine, comme montré ci-dessous. On appelle les ptérines les dérivés de la ptérine, c'est-à-dire les dérivés de la 2-amino-4-oxoptéridine, portant des groupes sur le noyau de pyrazine.
| Ptérine | |
| |
| Identification | |
|---|---|
| Nom UICPA | 2-amino-1H-ptéridin-4-one |
| No CAS | |
| No ECHA | 100.017.091 |
| No CE | 218-799-1 |
| SMILES | |
| InChI | |
| Apparence | poudre cristalline jaune-beige[1] |
| Propriétés chimiques | |
| Formule | C6H5N5O [Isomères] |
| Masse molaire[2] | 163,136 8 ± 0,006 5 g/mol C 44,17 %, H 3,09 %, N 42,93 %, O 9,81 %, |
| pKa | 2,20 à 20 °C 7,86 à 20 °C[3] |
| Propriétés physiques | |
| T° fusion | > 300 °C[1] |
| Précautions | |
| Directive 67/548/EEC[1] | |
 Xi |
|
| Écotoxicologie | |
| LogP | -1,890[4] |
| Unités du SI et CNTP, sauf indication contraire. | |
Occurrence naturelle
Les ptérines sont présentes dans de nombreuses biomolécules, notamment dans les pigments ptériniques qui donnent leur couleurs aux insectes, comme la xanthoptérine ; les ptérines furent d'ailleurs découvertes dans les pigments des ailes (pteron en grec, d'où leur nom) de papillon. Elles ont aussi un rôle important comme cofacteurs, comme la bioptérine ou l'acide folique (Vitamine B9).
Les dérivés de ce dernier, les folates, sont des ptérines « conjuguées » (conjugaison de type céto-énolique), portant en plus sur le carbone 6 du noyau ptéridine un groupe acide paraaminobenzoïque lui-même lié à un groupe glutamate. Ce sont des composés essentiels dans un grand nombre de réactions biochimiques de transfert de groupe. On compte parmi ces réactions biosynthétiques folato-dépendantes le transfert de groupes méthyle à l'homocystéine dans le cycle de la S-adénosylméthionine, ou le transfert de groupe formyle à la méthionine pour former la N-formylméthionine (fMet).
Propriétés
La ptérine se présente sous la forme de cristaux ou de poudre cristalline jaune à beige. Chauffée, elle se décompose sans fondre.
La ptérine possède deux pKa, un premier à 2,20 le second à 7,86 (eau, 20 °C)[3].
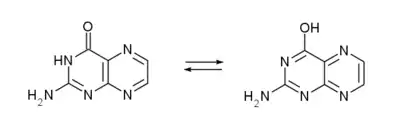
La ptérine possède de nombreuses formes tautomères, par la délocalisation des doubles liaisons dans les deux cycles, et sur les fonctions amine et cétone.
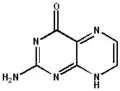
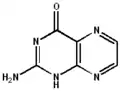
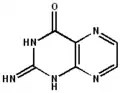
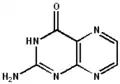
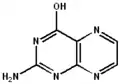 2-amino-4-hydroxyptéridine
2-amino-4-hydroxyptéridine
La tautomérie sur la fonction cétone[5] permet la création d'un isomère plus ou moins stable, la 2-amino-4-hydroxyptéridine forme énol de la ptérine, à partir de laquelle sont formés les folates :
Biosynthèse
La biosynthèse des ptérines se fait à partir de la guanosine triphosphate (GTP), avec l'aide de l'enzyme GTP cyclohydrolase I que l'on trouve aussi bien chez les procaryotes que chez les eucaryotes.
Synthèse
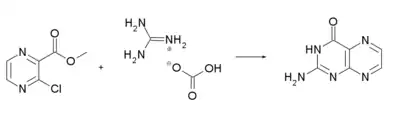
On peut réaliser la synthèse de la ptérine à partir de l'ester méthylique de la 2-carboxy-3-chloropyrazine et de l'hydrogénocarbonate de guanidinium[6].
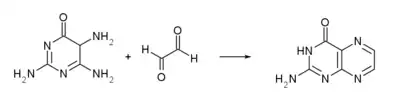
Une autre synthèse part de la 2,4,5-triamino-6-hydroxypyrimidine réagissant avec l'éthanedial[7].
Autres ptérines
La ptérine existe dans la nature sous différentes formes, dépendantes de leurs fonctions. La tétrahydrobioptérine, la principale ptéridine non conjuguée chez les vertébrés, est un cofacteur dans l'hydroxylation de composés aromatiques et la synthèse de l'oxyde nitrique. La molybdoptérine est une ptéridine substituée, qui se lie à du molybdène pour donner des cofacteurs d'oxydo-réductases impliqués dans les hydroxylations, la réduction des nitrates et l'oxydation respiratoire. La tétrahydrométhanoptérine est utilisée par les organismes méthanogéniques. La cyanoptérine est une version glycosylée de la ptéridine, dont la fonction est pour l'instant inconnue chez les cyanobactéries.
Voir aussi
- Ptéridine
- Tétrahydrobioptérine
- Molybdoptérine
- Cyanoptérine
- Tétrahydrométhanoptérine
- Acide folique (Vitamine B9)
Notes et références
- base de données Acros
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (de) Pfleiderer, W.; Liedek, E.; Lohrmann, R.; Rukwied, M.: Pteridine, X. Zur Struktur des Pterins in Chem. Ber. 93 (1960) 2015–2022. DOI 10.1002/cber.19600930916.
- (en) « », sur NIST/WebBook, consulté le 23 juin 2010
- Jaramillo, P.; Coutinho, K.; Canuto, S.: Solvent Effects in Chemical Processes. Water-Assisted Proton Transfer Reaction of Pterin in Aqueous Environment in J. Phys. Chem. A 113 (2009) 12485–12495. DOI 10.1021/jp903638n.
- Wood, D.: J. Chem. Soc. 1955, 1379–1380.
- Movat et. al.: J. Amer. Chem. Soc. 70 (1948) 14.
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Pterin » (voir la liste des auteurs).
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Pterin » (voir la liste des auteurs).