Perchlorate de fluor
Le perchlorate de fluor est un composé chimique de formule FClO4. C'est un gaz extrêmement instable à l'odeur pénétrante qui explose spontanément.
| Perchlorate de fluor | |
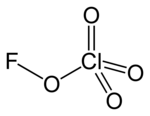 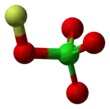 Structure du perchlorate de fluor |
|
| Identification | |
|---|---|
| Nom UICPA | (en) hypofluorite de perchloryle |
| Synonymes |
(en) (fluorooxy)chlorane trioxide |
| No CAS | |
| PubChem | 13022374 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | FClO4 |
| Masse molaire[1] | 118,449 ± 0,003 g/mol Cl 29,93 %, F 16,04 %, O 54,03 %, |
| Écotoxicologie | |
| LogP | 0,53[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
Il ne s'agit pas d'un analogue de l'acide perchlorique HClO4 dans la mesure où le fluor n'existe pas sous forme de cation F+, de sorte que l'oxygène est à l'état d'oxydation 0 en raison de l'électronégativité de cet élément, intermédiaire entre celles du chlore et du fluor.
Il peut être préparé à partir de fluor F2 et d'acide perchlorique HClO4 :
L'action du pentafluorure de chlore ClF5 sur l'eau H2O et la décomposition thermique du perchlorate de tétrafluoroammonium NF4ClO4 en sont deux autres voies de synthèse possibles, la dernière produisant un perchlorate de fluor très pur pouvant être manipulé et porté à basse température sans risque d'explosion :
- NF4ClO4 → NF3 + FClO4.
Le perchlorate de fluor est un oxydant fort pouvant réagir avec l'ion iodure I− :
Il peut également réagir avec le tétrafluoroéthylène C2F4 à travers peut-être une addition radicalaire :
- FClO4 + CF2CF2 → CF3CF2ClO4.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- http://www.chemicalize.org/structure/#!mol=O%3DCl%28%3DO%29%28%3DO%29OF