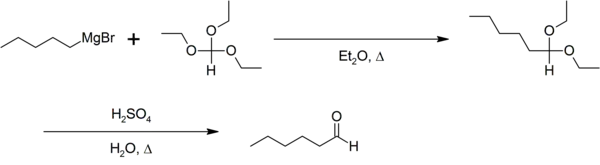Orthoformiate d'éthyle
L'orthoformiate d'éthyle est l'orthoester triéthylique de l'acide formique. Il est facilement disponible commercialement mais il peut être aussi préparé par réaction entre du chloroforme (CHCl3) et l'éthanolate de sodium (NaC2H5O)[4]:
- CHCl3 + 3 Na + 3 EtOH → HC(OEt)3 + 3/2 H2 + 3 NaCl
| Orthoformiate d'éthyle | |||
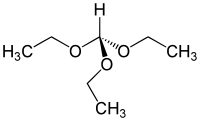
| |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | (diéthoxyméthoxy)éthane | ||
| Synonymes |
triéthoxyméthane, orthométhanoate d'éthyle |
||
| No CAS | |||
| No ECHA | 100.004.138 | ||
| No CE | 204-550-4 | ||
| No RTECS | RM6475000 | ||
| PubChem | 31214 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C7H16O3 [Isomères] |
||
| Masse molaire[1] | 148,200 1 ± 0,007 6 g/mol C 56,73 %, H 10,88 %, O 32,39 %, |
||
| Propriétés physiques | |||
| T° fusion | −76 °C[2] | ||
| T° ébullition | 146 °C[2] | ||
| Masse volumique | 0,891 g·cm-3 à 25 °C[2] | ||
| Point d’éclair | 35 °C[2] | ||
| Pression de vapeur saturante | 2,9 mmHg (20 °C)[2] | ||
| Propriétés optiques | |||
| Indice de réfraction | 1,391[2] | ||
| Précautions | |||
| SGH[2] - [3] | |||
 |
|||
| Transport | |||
|
|||
| Écotoxicologie | |||
| DL50 | 7060 mg/kg (rat, oral)[3] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
L'orthoformiate d'éthyle sert, en chimie, de solvant et/ou de réactif comme dans la synthèse d'aldéhyde de Bodroux-Chichibabin[5] :
En chimie de coordination, l'orthoformiate d'éthyle est utilisé pour substituer l'eau des complexes métalliques aqueux par des molécules d'éthanol[6] :
- [Ni(H2O)6](BF4)2 + 6 HC(OC2H5)3 → [Ni(C2H5OH)6](BF4)2 + 6 HC(O)(OC2H5) + 6 HOC2H5
Notes
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Triethyl orthoformate » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Triethyl orthoformate anhydrous, 98%, consultée le 15/09/2016.
- W. E. Kaufmann and E. E. Dreger, Ethyl orthoformate, Org. Synth., coll. « vol. 1 », , p. 258
- G. Bryant Bachman, n-Hexaldehyde, Org. Synth., coll. « vol. 2 », , p. 323
- Willem L. Driessen, Jan Reedijk, Solid Solvates: The Use of Weak Ligands in Coordination Chemistry, Inorg. Synth., 1992, vol. 29, pp. 111–118. DOI 10.1002/9780470132609.ch27.
Cet article est issu de wikipedia. Text licence: CC BY-SA 4.0, Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.