Octylphénol
Les octylphénols (ou « OP », de formule brute C14H22O) sont une sous-classe de molécules (alkylphénols) issues de la carbochimie, représentant un grand nombre d'isomères.
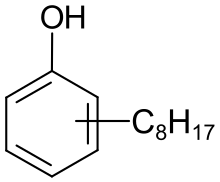
Le groupe octyle (C8H17) peut dans ce type de molécule être ramifié de plusieurs manières ou constituer une chaîne droite ; ce groupe octyle peut être situé en position -2, -3 ou -4 du cycle benzénique.
Parmi les isomères possibles, le 4-tert-octylphénol (principalement vendu comme détergent) a la plus grande importance commerciale et souvent le mot octylphénol le désigne[1] et est suspecté d'avoir contaminé le réseau trophique et parfois l'organisme humain[2].
Ce sont des polluants organiques notamment retrouvés adsorbés sur les particules en suspension[3] puis dans les sédiments des eaux douces et marines et des estuaires[1], avec des risques intergénérationnels car c'est un perturbateur endocrinien, lipophile et il est retrouvé (de même que des éthoxylates d'octylphénol) dans les tissus gras humains[4] et le lait maternel, moins que le nonylphénol (mais le nonylphénol peut être un produit de dégradation de l'octylphénol)[5]. Selon les dosages faits dans le lait de femmes italiennes, chez les femmes qui présentaient les taux les plus élevés, l'ingestion journalière est proche de la dose journalière tolérable (DJA) qui a été fixée à de 5 µg/kg de poids corporel par l'Institut danois de sécurité et de toxicologie[5].
Depuis le début des années 2000, l’octylphénol tend à remplacer le nonylphénol, mais il a à peu près les mêmes propriétés chimio-toxicologiques et les mêmes effets de perturbateur endocrinien et donc possiblement les mêmes risques pour l'environnement alertent le Canadian Council of Ministers of the Environment[6], puis Environnement Canada en 2004[7] - [8]
Production
Historiquement, depuis le début du XXe siècle, les octylphénols sont les alkylphénols qui ont été les plus utilisés par l'Industrie (20 % de la production totale) et plus encore les nonylphénols ou NPEO (80 % environ de la production )[9], mais dans certains usages les dodécylphénols tendent à remplacer les nonylphénols, notamment comme additif de certains lubrifiants (ex. : huile ROWE qui en contient un peu moins de 0,1 %). Il est fabriqué par réaction du phénol avec le di-isobutène (tert-octène) (Environment Agency, 2005)[10] en présence d'une résine échangeuse d’ions (à lit fixe dans le procédé continu ou avec une résine échangeuse d’ions sulfonés dans le procédé discontinu[11]. après quoi deux distillations sont nécessaires pour retirer les produits qui n'ont pas réagi.
En 2001, la production européenne d'octylphénol était estimée à 23 000 tonnes par an[12] (22 633 tonnes plus précisément, selon l'Anses, en 2015[13]).
Industriels producteurs
En Europe, ils sont représentés par le CEPAD (Conseil Européen des Phénols Alkylés et Dérivés).
Et avec d'autres industriels, ils ont fondé un laboratoire ECETOC (European Center for Ecotoxicology and Toxicology Of Chemicals) ; basé à Bruxelles, rue Belliard, non loin du Parlement européen, qui — selon son site internet — « représente ses membres devant l'ECHA, l'OMS et l'OCDE »[14].
Utilisations
Les octylphénols sont principalement des intermédiaires chimiques (comonomère) dans la production industrielle de résines phénoliques (qui sert principalement à fabriquer les pneus de véhicules ; 1,5 à 10 % de la formulation du caoutchouc), de résines isolantes de circuits électroniques ou d'éléments électriques ou électroniques, d'enroulement de fils métalliques de moteurs et de formaldéhyde ainsi que pour la fabrication d'éthoxylates d'octylphénol (utilisés dans le caoutchouc, les pesticides et les peintures). L'industrie pétrolière les utilise pour fabriquer de polymères (de peinture au latex ou ajoutés aux papiers peints[15]) et résines éthoxylées (émulsifiant et surfactant non-ionique notamment utilisés pour séparer l'eau du pétrole dans les plateformes de forage offshore, ou comme tensioactif pour améliorer la dispersion de liquides et la miscibilité de certains mélanges, comme composants de produits de nettoyage ou de finition du cuir ou de textiles (traitement de brillance, et anti-poussière)[15]. Ils sont utilisés dans des encres (plus adhésives et séchant plus vite) dans de nombreuses colles, des peintures marines (ainsi rendue plus résistantes au sel) et marginalement pour d'autres usages (par exemple comme spermicide[8].
Polluant
Il est peu soluble dans l'eau (mais se fixe bien sur la matière organique qui peut être mise en suspension dans l'eau, via l'érosion et le ruissellement), peu volatile et liposoluble.
Les activités anthropiques (principalement à partir d'eaux usées industrielles) et le ruissellement emportent ce produit vers les zones humides et cours d'eau (En règle générale, dans les cours d'eau de la planète, au début du XXIe siècle, les concentrations d'octylphénol (OP) sont comprises entre 0,001–1,44 μg/L ; à comparer à celles du bisphénol-A (BPA), entre 0,0005 et 4,0 μg/L) et à celles du nonylphénol (NP) encore plus importantes, car comprises entre 0,006 et 32,8 μg/L (sachant que le nonylphénol peut aussi être une impureté ou un produit de dégradation des deux autres)[8].
Les octylphénols finissent ensuite par contaminer le milieu marin, en tant qu'impureté du nonylphénol, produit de dégradation et sans doute aussi à partir de la décomposition des alkylphénol éthoxylés[1]. En France, selon l'INERIS il est très fréquemment trouvé dans les sédiments (96 % des échantillons en présentent une concentration supérieure à la limite de quantification, LQ)[16].
Sa pression de vapeur, basse, lui permet de s'adsorber sur les sols et sédiments, faisant qu'il ne stagne pas dans l'air (où en réagissant avec les radicaux hydroxyles, il serait plus rapidement dégradé). Dans l’eau et le sol, il est réputé être biodégradable, mais assez lentement, surtout en l’absence d’oxygène[8].
Écotoxicologie
Selon S. Veillette (2018), l’octylphénol « représente un danger écotoxicologique élevé pour les écosystèmes aquatiques ,compte tenu de son caractère persistant, bioaccumulable et toxique »[8] On lui reconnait notamment :
- des effets de perturbation endocrinienne (effet oestrogéniques) chez les animaux à sang chaud (mammifères)[17], et de même chez des animaux à sang froid tels que des mollusques gastéropodes[18]…, ainsi que chez les poissons[19])[1] ; L'exposition de femelles Guppy durant 90 jours à 100 µg/l induit une perte de poids des gonades et une baisse du nombre d'ovocytes[20].Une exposition du mâle à 38,5 µg/L durant le développement sexuel induit des gonades (testicules) et une spermatogenèse réduites, avec un phénomène d’intersexuation chez le Medaka (après 97 jours d'exposition). Et la parade nuptiale du Guppy ou de la truite sont réduites ;
- une toxicité chez la salamandre nord-américaine Ambystoma barbouri, dont les embryons de femelles exposés à 500 mg/L ne meurent pas mais présentent une éclosion retardée, avec une moindre survie larvaire, une moindre croissance des individus et un risque accru de malformations congénitales[21] ; de plus, « une exposition chronique à l'octylphénol a entraîné la mortalité, les retards d'éclosion, la réduction de la croissance et la léthargie les plus importants » (par rapport aux tests faits avec trois pesticides : atrazine (4, 40 et 400 mg/L), carbaryl (0,5, 5 et 50 mg/L) et endosulfan (0,1, 1 et 10 mg/L pour 31 jours et 0,1, 10 et 100 mg/L pour les six derniers jours)[21] ;
- des effets neurologiques et musculaire ? (donnée nouvelle) : une étude récente (2018) a porté sur les effets d’une exposition à l'octylphénol sur le système de défense antioxydant des tissus musculaires. L’espèce modèle choisie a été le poisson, Oreochromis niloticus (exposé à une dose sublétale d'octylphénol de 50,6 µg/L durant 24, 48, 72 et 96 heures, avec groupes témoins également observés. Les poissons exposés ont significativement (P <0,05) diminué leur activité enzymatique antioxydante (superoxyde dismutase, catalase et glutathion réductase, en fonction du temps, par rapport aux groupes témoins correspondants), alors que les taux de peroxydation lipidique et la génération de peroxyde d'hydrogène augmentaient significativement (P <0,05) dans tous les groupes exposés, suggérant la production de radicaux libres dans le muscle[22]. L'acétylcholinestérase a aussi présenté une moindre activité intramusculaire (P <0,05) après 48 heures d'exposition à l'octylphénol, évoquant un défaut de neurotransmission à la jonction neuromusculaire. L’histologie a montré une altération du muscle (dégénérescence, et fibres musculaires fendues après 24 et 48 h puis désorganisation complète des fibres musculaires après 72 h, produisant des faisceaux musculaires épaissis et raccourcis après 96 h de traitement à l'octylphénol[22] ;
- une certaine tendance à persister et à s'accumuler dans les sédiments (ex. : jusqu'à 13 µg/L dans l’estuaire des Tees au Royaume-Uni, et jusqu'à 0,32 mg/kg de poids sec) alors que dans les eaux côtières il dépasse rarement à 0,016 µg/L[1] ;
- une légère tendance à la bioaccumulation dans les tissus gras (en mer du Nord les poissons en contiennent souvent, mais à des doses généralement inférieures à la limite de quantification, soit 0,004 mg/kg de poids sec[1]) ;
- pas de tendance à la biomagnification[1] chez certaines espèces comme (poisson plat Pleuronectes (grâce à une glucuronidation efficace[23]) mais des indices plaident pour une certaine bioamplification chez certaines espèces (à tissus gras ou dotées d'un métabolisme propice à l'accumulation de ce polluant (Saumon, Phoques, Globicéphales...). L'octylphénol semble encore plus bioconcentré que le nonylphénol chez le saumon atlantique (facteur de bioconcentration de 331, à comparer à 280 pour le nonylphénol), mais pas chez la truite arc en ciel (FBC=98 selon Lewis & lech, 1996[24]). Son FBC est également beaucoup plus élevé que celui cu buthylphénol. Les phoques danois en contiennent de 25 à 472 ng/g[25] alors que l'Anchois du Pérou n'en contient « que » 0,8 à 1,7 ng/g[8] ;
- une toxicité pour de nombreux organismes marins au-dessus de 6,1 µg/L.
Toxicité
L'octylphénol ne présent pas d'effet génotoxique selon les études disponibles (sur le modèle animal)[8].
Sa toxicité est bien plus élevés (pour les poissons par exemple) que ne l'est celle des alkylphénols à chaines courtes. Ex : la CL50 (96 h) est de 5,1 mg/L pour le poisson Méné à grosse tête, contre seulement 0,29 mg/L pour celle de l'octylphénol. Chez les crustacés, la toxicité varie selon l’espère : la crevette marine Acartia tonsa s’y montre très sensible, bien plus que la daphnie en eau douce : cinq jours d'exposition à de l'eau à 0,0013 mg/L d'octylphénol (dose très faible) tue la moitié des Acartias[26] La CE50 pour cinq jours d'exposition à une eau contenant 0,12 mg/L d'octylphénol tue 50 % des truites arc-en-ciel exposées[27] et ce poisson est aussi très vulnérable à l'effet endocrinien[8] (voir p. 52-53).
Cinétique environnementale
Selon les modèles de fugacité de l'OCDE, les octylphénols s'adsorbent très bien dans les sols, ont une courte durée de demi-vie dans l'air (0,25 jour car dégradé par les radicaux hydroxyles) mais la pluie pourraient contribuer à les amener au sol[8]; ils sont donc réputés ne pas diffuser très loin de leurs source d'émission. Un peu plus de 1 % des émissions aériennes environ seraient stocké dans le sédiment (où sa demi-vie est assez longue : 150 jours surtout en condition anoxique) et 67,7 % passerait dans le sol[8] (voir p. 26-27).
Le sédiment en suspension dans l'eau de zones industrialisées se montre 5 à 35 fois plus (trans-)porteur d’octylphénols que les lits de sédiments des cours d'eau (où en condition anaérobie les octophénols ne se biodégradent pas du tout selon Johnson et al. (2000)[28].
Une grande partie de ces molécules traversent les {stations d'épuration sans être dégradées ou en étant incomplètement dégradées[29].
L'octylphénol et abondant dans l'air près de routes (selon une étude allemande), probablement en raison de l'érosion des gommes de pneumatiques de véhicules. On en trouve en fait de faibles quantité dans l'air partout où on l'a cherché, avec un record au japon (5,3ng/m3 selon Saito et al 2004[30]).
Législation
Le nonylphénol et ses dérivés éthoxylés ont été ajoutés à la liste des substances toxiques de la LCPE en .
De nombreux pays cherchent à le réduire voire à l’éradiquer à long terme, au profit d’alternatives moins toxiques. L’octylphénol présente en effet une écotoxicité et une toxicité qui a été maintes fois comparée à celle du nonylphénol (en raison d’expérimentations et parce que leurs propriétés physico-chimiques sont a priori similaires), et bien qu’il présente un potentiel œstrogénique trente fois supérieur à celui du nonylphénol (selon Routledge et Sumpter 1997) après 20 ans, l’octylphénol ne figure toujours pas sur la liste des substances toxiques prioritaires[31].
Notes et références
- OSPAR (2006) OSPAR background document on octylphenol | Commission OSPAR
- Calafat, A. M., Ye, X., Wong, L. Y., Reidy, J. A. et Needham, L. L. (2007), Exposure of the US population to bisphenol A and 4-tertiary-octylphenol: 2003–2004.Environmental health perspectives, 116(1), 39-44.
- Isobe, T., Nishiyama, H., Nakashima, A. et Takada, H. (2001). Distribution and behavior of nonylphenol, octylphenol, and nonylphenol monoethoxylate in Tokyo metropolitan area: their association with aquatic particles and sedimentary distributions. Environmental Science & Technology, 35(6), 1041-1049 (résumé).
- Lopez-Espinosa, M. J., Freire, C., Arrebola, J. P., Navea, N., Taoufiki, J., Fernandez, M. F.... & Olea, N. (2009). Nonylphenol and octylphenol in adipose tissue of women in Southern Spain. Chemosphere, 76(6), 847-852.
- Ademollo, N., Ferrara, F., Delise, M., Fabietti, F. et Funari, E. (2008). Nonylphenol and octylphenol in human breast milk. Environment international, 34(7), 984-987 (résumé).
- Canadian Council of Ministers of the Environent (CCME) (2002) Canadian water quality guidelines for the protection of aquatic life: Nonylphenol and its ethoxylates. URL: à http://ceqg-rcqe.ccme.ca/download/en/198/
- Environnement Canada. (2004). Stratégie de gestion du risque concernant le nonylphénol et ses dérivés éthoxylés en vertu de la LCPE (1999) | URL: http://publications.gc.ca/collections/collection _2014/ec/En14-139-2004-fra.pdf
- Veillette, C. (2018). Évaluation du danger écotoxicologique du butylphénol et de l'octylphénol et proposition de solutions adaptées [PDF] (Doctoral dissertation, Université de Sherbrooke), 110 p.
- Berryman, D., Deblois, C., O'Shea, M. et Houde, F. (2003), Suivi des nonylphénols ethoxylés dans l'eau brute et l'eau traitée de onze stations de traitement d'eau potable au Québec, ministère de l'Environnement, Direction du suivi de l'état de l'environnement.
- Environment Agency. (2005a). Environmental risk evaluation report: 4-tert-octylphenol. | URL :https://www.gov.uk/government/uploads/system/uploads/attachment_data/file/290844/scho0405biyz-e-e.pdf
- Bontje, D., Hermens, J., Vermeire, T. et Damstra, T. (2004). Integrated risk assessment: Nonylphenol case study | URL : http://www.who.int/ipcs/methods/Nonylphenol.pdf
- Daphnis De Pooter (2013): Octylphénol. URL: http://www.coastalwiki.org/wiki/Octylphénol [consulté le 16-10-2019]..
- Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (Anses) (2015). Caractérisation des dangers et des expositions du 4-tert-octylphénol. (Rapport d’expertise collective) URL: https://www.anses.fr/fr/system/files/SUBCHIM2009SA0331-107.pdf
- Source : We represent our members in EU and international organisations: ECHA, WHO and OECD. ; We develop tools to streamline evaluation, registration and management of safe chemistry ; Our member companies and the regulatory authorities gain practical scientific understanding and knowledge that they can apply in their organisations ; ECETOC helps its members navigate through REACH (Evaluation, Authorisation and Restriction) and CLH technicalities. ; sell : Benefits of Membership (consulté le 2 octobre 2019)
- Institut national de l’environnement industriel et des risques (INERIS) (2017) Données technico-économiques sur les substances chimiques en France : octylphénols et éthoxylates. (Numéro de rapport : DRC-16-158744-11472A). Paris, France
- Hennebert P, Padox J. M et Hazebrouck B (2011), Substances prioritaires dangereuses et émergentes dans les sédiments: quelques données françaises. Mines & Carrières, (181, Hors-série no 8), 16-22.
- Laws, S. C., Carey, S. A., Ferrell, J. M., Bodman, G. J. et Cooper, R. L. (2000). Estrogenic activity of octylphenol, nonylphenol, bisphenol A and methoxychlor in rats. Toxicological Sciences, 54(1), 154-167.
- Oehlmann, J., Schulte-Oehlmann, U., Tillmann, M. et Markert, B. (2000), Effects of endocrine disruptors on prosobranch snails (Mollusca: Gastropoda) in the laboratory. Part I: Bisphenol A and octylphenol as xeno-estrogens. Ecotoxicology, 9(6), 383-397.
- Gray, M. A., Niimi, A. J. et Metcalfe, C. D. (1999). Factors affecting the development of testis‐ova in medaka, Oryzias latipes, exposed to octylphenol. Environmental Toxicology and Chemistry: An International Journal, 18(8), 1835-1842 (résumé).
- Toft, G. et Baatrup, E. (2003). Altered sexual characteristics in guppies (Poecilia reticulata) exposed to 17β-estradiol and 4-tert-octylphenol during sexual development. Ecotoxicology and Environmental Safety, 56(2), 228-237
- Rohr, J. R., Elskus, A. A., Shepherd, B. S., Crowley, P. H., McCarthy, T. M., Niedzwiecki, J. H. … et Palmer, B. D. (2003), Lethal and sublethal effects of atrazine, carbaryl, endosulfan, and octylphenol on the streamside salamander (Ambystoma barbouri), Environmental Toxicology and Chemistry: An International Journal, 22(10), 2385-2392.
- Jayasree, P. J., Sumi, N. et Chitra, K. C. (2018). Response of antioxidant defense system in the muscle tissue of Oreochromis niloticus after exposure to octylphenol. IJAR, 4(1), 268-274.
- Nurulnadia, M. Y., Koyama, J., Uno, S. et Amano, H. (2016). Biomagnification of endocrine disrupting chemicals (EDCs) by Pleuronectes yokohamae: Does P. yokohamae accumulate dietary EDCs?. Chemosphere, 144, 185-192.
- Lewis, S. K. et Lech, J. J. (1996). Uptake, disposition, and persistence of nonylphenol from water in rainbow trout (Oncorhynchus mykiss). Xenobiotica, 26(8), 813-819.
- Hansen, A. B. et Lassen, P. (2008). Screening of phenolic substances in the Nordic environments. URL :http://www.academia.edu/12995192/Screening_of_phenolic_substances_in_the_Nordic_environments
- Andersen, H. R., Wollenberger, L., Halling -Sorensen, B. et Kusk, K. O. (2001). Development of copepod nauplii to copepodites: A parameter for chronic toxicity including endocrine disruption. Environmental Toxicology and Chemistry, 20(12), 2821-2829.
- OCDE (1995), Phenol, 4-(1,1,3,3-tetramethylbutyl), CAS n° , http://www.inchem.org/documents/sids/sids/140669.pdf
- Johnson, A. C., White, C. Bhardwaj, L. et Jürgens, M. D. (2000), Potential for octylphenol to biodegrade in some English rivers, Environmental Toxicology and Chemistry, 19(10), 2486-2492.
- Maguire, R. J. (1999), Review of the persistance of nonylphenol and nonylphenol ethoxylates in aquatic environments, Water Quality Research Journal of Canada, 34(1), 37-78.
- Saito, I., Onuki, A. et Seto, H. (2004), Indoor air pollution by alkylphenols in Tokyo. Indoor Air, 14(5), 325-332
- Veillette, C. (2018). Évaluation du danger écotoxicologique du butylphénol et de l'octylphénol et proposition de solutions adaptées (Doctoral dissertation, Université de Sherbrooke), PDF, 110 pp| voir p 78/119.
Voir aussi
Articles connexes
Liens externes
- Octylphénol dans la base de données ED North
- Document de fond OSPAR sur octylphénol
Bibliographie
- Commission OSPAR, 2006: Document de base OSPAR sur l'octylphénol
- Isobe, T., Nishiyama, H., Nakashima, A., & Takada, H. (2001). Distribution and behavior of nonylphenol, octylphenol, and nonylphenol monoethoxylate in Tokyo metropolitan area: their association with aquatic particles and sedimentary distributions. Environmental Science & Technology, 35(6), 1041-1049 (résumé)
- Jayasree, P. J., Sumi, N., & Chitra, K. C. (2018). Response of antioxidant defense system in the muscle tissue of Oreochromis niloticus after exposure to octylphenol. IJAR, 4(1), 268-274
- Ko, D. S., Lee, D. R., Song, H., Kim, J. H., & Lim, C. K. (2019). Octylphenol and nonylphenol affect decidualization of human endometrial stromal cells. Reproductive Toxicology (résumé).
- Nurulnadia, M. Y., Koyama, J., Uno, S., & Amano, H. (2016). Biomagnification of endocrine disrupting chemicals (EDCs) by Pleuronectes yokohamae: Does P. yokohamae accumulate dietary EDCs?. Chemosphere, 144, 185-192.
- Raychoudhury, S. S., Blake, C. A., & Millette, C. F. (1999). Toxic effects of octylphenol on cultured rat spermatogenic cells and Sertoli cells. Toxicology and applied pharmacology, 157(3), 192-202.
- Rohr, J. R., Elskus, A. A., Shepherd, B. S., Crowley, P. H., McCarthy, T. M., Niedzwiecki, J. H.... & Palmer, B. D. (2003). Lethal and sublethal effects of atrazine, carbaryl, endosulfan, and octylphenol on the streamside salamander (Ambystoma barbouri). Environmental Toxicology and Chemistry: An International Journal, 22(10), 2385-2392.
- Sharma, V. K., Anquandah, G. A., Yngard, R. A., Kim, H., Fekete, J., Bouzek, K.... & Golovko, D. (2009). Nonylphenol, octylphenol, and bisphenol-A in the aquatic environment: a review on occurrence, fate, and treatment. Journal of Environmental Science and Health Part A, 44(5), 423-442 ; ...en en vue du grade de maître en environnement (résumé).
- Staples, C. A., Williams, J. B., Blessing, R. L., & Varineau, P. T. (1999). Measuring the biodegradability of nonylphenol ether carboxylates, octylphenol ether carboxylates, and nonylphenol. Chemosphere, 38(9), 2029-2039 (résumé).
- Veillette, C. (2018). Évaluation du danger écotoxicologique du butylphénol et de l'octylphénol et proposition de solutions adaptées (Doctoral dissertation, Université de Sherbrooke), PDF, 110 pp.
- Xu, L. C., Sun, H., Chen, J. F., Bian, Q., Qian, J., Song, L., & Wang, X. R. (2005). Evaluation of androgen receptor transcriptional activities of bisphenol A, octylphenol and nonylphenol in vitro. Toxicology, 216(2-3), 197-203 (résumé).