Nitrate de rhodium(III)
Le nitrate de rhodium(III) est un composé chimique de formule Rh(NO3)3. Il n'a pas été isolé à l'état pur[3] mais on en connaît un hydrate et une solution aqueuse de stœchiométrie correspondante, ainsi que divers complexes de rhodium(III) hexacoordonné avec des ligands aqua et nitrate[4]. D'autres nitrates de rhodium ont été caractérisés par cristallographie aux rayons X, comme Rb4[trans-[Rh(H2O)2(NO3)4][Rh(NO3)6][3] et Cs2[Rh(NO3)5][5]. L'étude des nitrates de rhodium revêt un certain intérêt dans la mesure où les déchets nucléaires, qui contiennent du rhodium, sont retraités par dissolution dans l'acide nitrique HNO3[6].
| Nitrate de rhodium(III) | |||
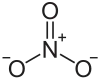 |
|||
| Ions constitutifs du nitrate de rhodium(III). | |||
| Identification | |||
|---|---|---|---|
| Nom systématique | nitrate de rhodium(III) | ||
| Synonymes |
trinitrate de rhodium |
||
| No CAS | (Dihydrate) |
||
| No ECHA | 100.030.348 | ||
| No CE | 233-397-6 | ||
| No RTECS | VI9316000 | ||
| PubChem | 150190 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide brun-rouge à l'odeur acide[1] | ||
| Propriétés chimiques | |||
| Formule | N3O9Rh |
||
| Masse molaire[2] | 288,920 2 ± 0,003 3 g/mol N 14,54 %, O 49,84 %, Rh 35,62 %, |
||
| Précautions | |||
| SGH[1] | |||
    Danger |
|||
| NFPA 704[1] | |||
| Transport[1] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Le nitrate de rhodium(III) dihydraté Rh(NO3)2·2H2O est un solide vert olive très soluble dans l'eau. Il peut être obtenu en faisant réagir de l'oxyde de rhodium(III) pentahydraté Rh2O3·5H2O avec de l'acide nitrique HNO3 à 79 à 80 °C[7].
Notes et références
- « Fiche du composé Rhodium(III) nitrate solution, Rh 10-15% w/w (cont. Rh) », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Danila Vasilchenko, Sofia Vorob'eva, Sergey Tkachev, Iraida Baidina, Anatoliy Belyaev, Sergey Korenev, Leonid Solovyov et Alexander Vasiliev, « Rhodium(III) Speciation in Concentrated Nitric Acid Solutions », European Journal of Inorganic Chemistry, no 23, , p. 3822-3828 (DOI 10.1002/ejic.201600523, lire en ligne).
- (en) R. Caminiti, D. Atzei, P. Cucca, A. Anedda et G. Bongiovanni, « Structure of rhodium(III) nitrate aqueous solutions. An investigation by X-ray diffraction and Raman spectroscopy », The Journal of Physical Chemistry, vol. 90, no 2, , p. 238-243 (DOI 10.1021/j100274a007, lire en ligne).
- (en) Danila Vasilchenko, Sofia Vorobieva, Iraida Baidina, Dmitry Piryazev, Athanassios Tsipis et Sergey Korenev, « Structure and properties of a rhodium(III) pentanitrato complex embracing uni- and bidentate nitrato ligands », Polyhedron, vol. 147, , p. 69-74 (DOI 10.1016/j.poly.2018.03.017, S2CID 104064801, lire en ligne).
- (en) Alex C. Samuels, Cherilynn A. Boele, Kevin T. Bennett, Sue B. Clark, Nathalie A. Wall et Aurora E. Clark, « Integrated Computational and Experimental Protocol for Understanding Rh(III) Speciation in Hydrochloric and Nitric Acid Solutions », Inorganic Chemistry, vol. 53, no 23, , p. 12315-12322 (PMID 25390284, DOI 10.1021/ic501408r, lire en ligne).
- (de) Georg Brauer, Handbuch der Präparativen Anorganischen Chemie, 3e éd., vol. 3, Ferdinand Enke, Stuttgart, 1981, p. 1741. (ISBN 3-432-87823-0)

![{\displaystyle \mathrm {\ \!\ {\Biggr ]}_{3}^{-}} }](https://img.franco.wiki/i/9db8459a48d964bf7f88fb4159c82f09c14fe41d.svg)


