Méthiopropamine
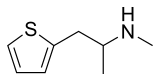
La méthiopropamine (MPA) est un analogue thiophène de la méthamphétamine, synthétisé pour la première fois en 1942 pour comparer ses propriétés pharmacologiques avec celles de ses analogues phényles[2]. Chimiquement parlant, ce n'est ni une phényléthylamine ni une amphétamine et ce n'est pas non plus un de leurs analogues fonctionnels. Elle est apparue sur le marché au Royaume-Uni en comme nouveau produit de synthèse[3]. Elle n'est pas considérée par les utilisateurs comme une drogue particulièrement euphorisante ou récréative[4].
| Méthiopropamine | |
| |
| Identification | |
|---|---|
| Nom UICPA | 1-(thiophène-2-yl)-2-méthylaminopropane |
| No CAS | (chlorhydrate) |
| Code ATC | |
| PubChem | 436156 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C8H13NS [Isomères] |
| Masse molaire[1] | 155,261 ± 0,013 g/mol C 61,89 %, H 8,44 %, N 9,02 %, S 20,65 %, |
| Caractère psychotrope | |
| Catégorie | Stimulant |
| Mode de consommation |
Ingestion |
| Risque de dépendance | Inconnu, a priori faible |
| Unités du SI et CNTP, sauf indication contraire. | |
Pharmacologie
La méthiopropamine agit comme un inhibiteur sélectif de la recapture de la dopamine et de la noradrénaline, environ 1,85 fois plus sélectif pour la noradrénaline que pour la dopamine. Elle est environ trois fois moins puissante que la dextroamphétamine en tant qu'inhibiteur de la recapture de la noradrénaline et cinq fois moins en tant qu'inhibiteur de la recapture de la dopamine. Elle possède également une activité minime en tant qu'inhibiteur de la recapture de la sérotonine[5] - [6]
Synthèse
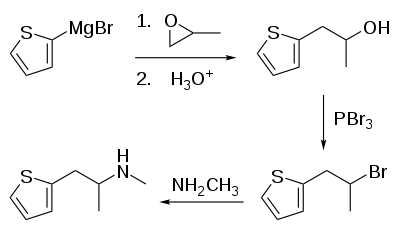
La synthèse de la méthiopropamine se fait en quatre étapes. Elle commence par le (thiophène-2-yl)bromure de magnésium, qui est mis en réaction avec de l'oxyde de propylène, donnant du 1-(thiophène-2-yl)-2-hydroxypropane qui ensuite réagit avec du tribromure de phosphore, donnant du 1-(thiophène-2-yl)-2-bromopropane qui va finalement réagir avec de la méthylamine, donnant du 1-(thiophène-2-yl)-2-méthylaminopropane[7].
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- F. F. Blicke et J. H. Burckhalter, « α-Thienylaminoalkanes », Journal of the American Chemical Society, vol. 64, no 3, , p. 477–80 (DOI 10.1021/ja01255a001)
- D Angelov, J O'Brien et P Kavanagh, « The syntheses of 1-(2-thienyl)-2-(methylamino) propane (methiopropamine) and its 3-thienyl isomer for use as reference standards », Drug testing and analysis, vol. 5, no 3, , p. 145–9 (PMID 21770051, DOI 10.1002/dta.298)
- Methiopropamine Thread at UKChemicalResearch.org
- L. Iversen, S. Gibbons, R. Treble, V. Setola, X. P. Huang et B. L. Roth, « Neurochemical profiles of some novel psychoactive substances », European Journal of Pharmacology, vol. 700, nos 1–3, , p. 147–151 (PMID 23261499, PMCID 3582025, DOI 10.1016/j.ejphar.2012.12.006)
- Hyung Shin Yoon, Wen Ting Cai, Young Hun Lee, Kyung Tae Park, Yong Sup Lee et Jeong-Hoon Kim, « The expression of methiopropamine-induced locomotor sensitization requires dopamine D2, but not D1, receptor activation in the rat », Behavioural Brain Research, vol. 311, , p. 403–7 (PMID 27265782, DOI 10.1016/j.bbr.2016.05.060, lire en ligne)
- John F. Casale et Patrick A. Hays, « Methiopropamine: An Analytical Profile », Microgram Journal, vol. 8, no 2, , p. 53–7 (lire en ligne)