Hirondelle bicolore
Tachycineta bicolor

L'Hirondelle bicolore (Tachycineta bicolor) est une espèce de passereaux appartenant à la famille des Hirundinidae.
Description
Cet oiseau mesure environ 13,5 cm et pèse environ 20 g. Il a le dos bleu-vert iridescent, la poitrine blanche et le bec noir.
Un dichromatisme sexuel existe entre les mâles et les femelles. Les femelles sont plus vertes et moins brillantes que les mâles[1]. La coloration iridescente de l’Hirondelle est formée par la microstructure de la plume. La superposition d’une couche mince et uniforme de granules de mélanine sous une couche de kératine dans les barbules des plumes[2] amène le phénomène physique appelé «interférence par couches minces». C’est le même phénomène qui crée la coloration observée sur une bulle de savon ou sur de l’huile sur de l’eau.
Les femelles ont une particularité appelée la maturation retardée du plumage[3]. Les femelles âgées d’un an ont un plumage brun similaire à celui des jeunes de l’année, parfois avec une légère coloration verte. Il est proposé que ce plumage brun diminue les agressions faites par les autres femelles. Cette espèce est une des rares chez qui on observe ce phénomène chez les femelles.

.jpg.webp)
Par la couleur seulement, il est possible de distinguer les femelles d’un an brunes des autres (femelles de 2 ans et mâles). Lorsqu’on a affaire à un mâle et une femelle tous deux iridescents, on ne doit pas se fier uniquement à la couleur, puisque certaines femelles peuvent être aussi bleues et brillantes que certains mâles. Il faut se fier aussi à ces autres critères[4] :
- Le mâle est plus gros et a souvent les plumes hérissées (particulièrement celles de la couronne) et a souvent la poitrine d’un blanc plus éclatant ;
- Le mâle est plus constamment perché sur le nichoir et attaque plus les intrus entrant dans une zone de 15 m du nichoir ;
- La femelle iridescente peut avoir une bande de plumes brunes autour du bec.
La mue s’effectue durant l’automne, parfois certaines plumes de la couronne muent durant l’hiver[1].
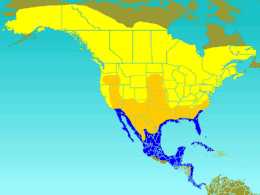
- zone de nidification
- voie de passage
- aire d'hivernage
Répartition et habitat
Répartition
L’hirondelle bicolore niche dans une large partie de l'Amérique du Nord, jusqu'à la limite des arbres au nord du Canada, et dans tous les états des États-Unis excepté les plus au sud (la côte californienne faisant exception), le sud des Rocheuses et des Grandes Plaines[5].
Migration
Les populations d'hirondelle bicolore sont pratiquement toutes migratrices, quittant leur zone de reproduction dès juillet-août jusqu'à tard dans l'automne, pour rejoindre le Mexique, la côte sud des États-Unis (notamment la Floride), Cuba et les pays du sud de l'Amérique centrale[5].
Elle migre durant le jour, en altitude, se regroupant en dortoirs durant la nuit pouvant contenir des centaines ou des milliers d'oiseaux[5].
Écologie et comportement
Alimentation
Elle se nourrit d'insectes, majoritairement de diptères, principalement aquatiques ; ses proies incluent également les anisoptères, les hyménoptères, les coléoptères et les hémiptères. Il se concentre sur les proies aquatiques à la saison de la reproduction, ajoutant les éphémères et les lépidoptères à son régime[7].
Elle capture ses proies en vol dans des surfaces ouvertes, pouvant même pêcher des insectes à la surface de l'eau. On peut plus rarement la retrouver au sol pour se nourrir[5].
Les juvéniles sont nourris essentiellement avec des larves d'origine aquatique, mais aussi des insectes équitablement répartis entre terrestres et aquatiques[8].
Reproduction
Il est nicheur cavicole secondaire, c’est-à-dire qu’il niche dans des trous que d’autres oiseaux ont déjà formés dans des arbres morts (exemple : pic, canard) et s’accommode bien de nichoirs artificiels[1]. L’hirondelle bicolore est la première hirondelle à arriver au Québec[9]. La raison est qu’elle est la seule à pouvoir s’alimenter d’autre chose que des insectes, comme les baies du myrique beaumier[1]. Le mâle arrive avant la femelle, et revient souvent au même territoire année après année. La femelle est moins philopatrique[10]. Ainsi, plus souvent les individus ne forment pas le même couple année après année[11].

Comme l’hirondelle est un nicheur cavicole secondaire, les sites de nidification sont plutôt rares, ainsi, elle a un comportement agressif envers les autres individus lors de la nidification (les mâles comme les femelles)[1]. Une fois le couple formé, la femelle entreprend la construction du nid seule (avec des herbes séchées en grande partie), et le mâle peut ajouter la touche finale par des plumes d’autres espèces qu’il va chercher aux alentours, par exemple des plumes de goéland et de dindon. Les mâles semblent jouer entre eux avec les plumes en vol[1]. Lorsqu’on laisse tomber une plume près d’un mâle, il tend à aller la chercher en vol.
La femelle pond entre 4 et 6, rarement 7, œufs blancs. Elle pond ses œufs le matin, à raison de 1 par jour. La fertilisation se fait par le mâle du couple, mais aussi avec d’autres mâles des environs. La femelle a été observée s’éloigner jusqu’à 10 km de son nichoir durant sa période fertile[12], ainsi les reproductions hors couple peuvent se faire relativement loin. La femelle semble contrôler les reproductions hors couple, puisqu’elle a été vue les solliciter, mais aussi exprimer un refus de copulation (en soulevant la queue) sans agression de la part du mâle[13].

Les oisillons sont nidicoles, donc naissent sans plumes et très petits, après environ 14-15 jours d’incubation. Ils prennent approximativement 16-22 jours gagner une vingtaine de grammes et s’envoler[1]. Le mâle et la femelle se partagent la tâche des soins aux oisillons (apport d’insectes et retrait des fientes hors du nid). Le mâle effectue des soins même si tous les oisillons ne sont parfois pas les siens. En moyenne, 50 % des jeunes de la nichée sont les siens, et 85 % des nichées contiennent au moins 1 oisillon hors couple[14]. Il s’agit donc d’une des espèces avec le plus grand taux de reproductions hors couple observé chez les oiseaux[15].
Des études ont été faites sur la sélection sexuelle de la coloration chez les mâles. Les mâles plus brillants ont plus de jeunes hors couple, c’est-à-dire des jeunes produits dans d’autres nids que le sien[16]. Les femelles plus vertes et moins brillantes ont un meilleur succès reproducteur[17].
Longévité
Cet oiseau vit en moyenne 2,7 ans, mais certains individus atteignent 8 ans[18].
Prédation
Les nids d'hirondelle sont victimes de nombreux prédateurs incluant le raton-laveur, l'Ours noir, la Crécerelle d'Amérique, le Quiscale bronzé ou encore la Corneille d'Amérique[5].
Les individus adultes sont principalement la proie de rapaces comme l'Épervier brun, le Grand-duc d'Amérique ou le Faucon émerillon[5].
Les hirondelles adultes peuvent émettre un cri d'alarme lorsqu'elles repèrent un prédateur pour signifier aux juvéniles de baisser la tête[19]. Elles défendent leur nid face aux prédateurs, le mâle plus agressivement que la femelle[20].
Systématique
L'hirondelle bicolore a été décrite pour la première fois par l'ornithologue français Louis-Pierre Vieillot en 1808, sous le nom Hirundo bicolor. L'espèce est actuellement considérée comme monotypique[21]. Hirundo viridis, leucogaster et prasina sont des synonymes de cette espèce[5] - [22]. Une sous-espèce Tachycineta bicolor vespertina a déjà été proposée (initialement par Cooper en 1876) mais n'est pas reconnue[22].
L'hirondelle bicolore et l'humain
Conservation
L'hirondelle bicolore est classée comme "préoccupation mineure" par l'UICN, en raison de sa large population qui reste stable[23]. Cependant, sa proximité avec l'eau la rend vulnérable à la contamination par certains métaux lourds comme le mercure[24].
Elle subit au Québec un déclin de 4 % par an depuis 1970[25].
Notes et références
- « Tree Swallow — Birds of North America Online », sur bna.birds.cornell.edu (consulté le ).
- (en) Chad M. Eliason et Matthew D. Shawkey, « Rapid, reversible response of iridescent feather color to ambient humidity », Optics Express, vol. 18, , p. 21284-21292 (ISSN 1094-4087, PMID 20941024, lire en ligne, consulté le ).
- (en) Lozano, G et Handford, P., « A Test of an Assumption of Delayed Plumage Maturation Hypotheses Using Female Tree Swallows. », the Wilson Bulletin, no 107, , p. 153-164.
- (en) Cohen, R, « Criteria for distinguishing breeding male tree swallows from brightly colored females prior to capture. », North American Bird Bander, no 9, , p. 2-3.
- (en) David W. Winkler, Kelly K. Hallinger, Daniel R. Ardia et R. J. Robertson, « Tree Swallow (Tachycineta bicolor), version 1.0 », Birds of the World, (DOI 10.2173/bow.treswa.01, lire en ligne, consulté le )
- (en) Andrew S Elgin, Robert G Clark, Christy A Morrissey, « Tree Swallow selection for wetlands in agricultural landscapes predicted by central-place foraging theory », Ornithological Applications, vol. 122, (lire en ligne)
- (en) Peter J. Blancher et Donald K. McNicol, « Tree swallow diet in relation to wetland acidity », Canadian Journal of Zoology, vol. 69, no 10, , p. 2629–2637 (ISSN 0008-4301 et 1480-3283, DOI 10.1139/z91-370, lire en ligne, consulté le )
- Jean M. Mengelkoch, Gerald J. Niemi et Ronald R. Regal, « Diet of the Nestling Tree Swallow », The Condor, vol. 106, no 2, , p. 423–429 (ISSN 1938-5129, DOI 10.1093/condor/106.2.423, lire en ligne, consulté le )
- « Carte de répartition eBird--Hirondelle bicolore », sur ebird.org (consulté le ).
- (en) Winkler, D.W. et al, « Breeding Dispersal and Philopatry in the Tree Swallow. », The Condor, no 106, , p. 768-776.
- (en) Llambias, P.e", Wrege, D. et Winkler, D. W., « Effects of site fidelity and breeding performance on mate retention in a short-lived passerine, the tree swallow Tachycineta bicolor », Journal of Avian Biology, no 39, , p. 493-499 (DOI 10.1111/j.2008.0908-8857.04274.x).
- (en) Dunn, P.O. et Whittingham, L.A., « Radio-tracking of female Tree Swallows prior to egg-laying. », Journal of Field Ornithology, no 76, , p. 259-263.
- (en) Venier, L. et al., « Behavioural patterns of extra-pair copulation in tree swallows. », Animal Behaviour, no 45, , p. 4112-415.
- (en) Andréanne Lessard, Audrey Bourret, Marc Bélisle et Fanie Pelletier, « Individual and environmental determinants of reproductive success in male tree swallow (Tachycineta bicolor) », Behavioral Ecology and Sociobiology, vol. 68, , p. 733-742 (ISSN 0340-5443 et 1432-0762, DOI 10.1007/s00265-014-1686-y, lire en ligne, consulté le ).
- (en) Griffith, S.C., Owens, I.P.F. et Thuman, K., « . Extra pair paternity in birds : a review of interspecific variation and adaptative function. », Molecular Ecology, no 11, , p. 2195-2212.
- (en) Pierre-Paul Bitton, Erin L. O'Brien et Russell D. Dawson, « Plumage brightness and age predict extrapair fertilization success of male tree swallows, Tachycineta bicolor », Animal Behaviour, vol. 74, , p. 1777-1784 (DOI 10.1016/j.anbehav.2007.03.018, lire en ligne, consulté le ).
- (en) Bentz, A.B. et Siefferman, L., « Age-dependent relationships between coloration and reproduction in a species exhibiting delayed plumage maturation in females. », Journal of Avian Biology, no 44, , p. 80-88.
- (en) Butler, R.W., « Population Dynamics and Migration Routes of Tree Swallows, Tachycineta bicolor, in North America. », Journal of field Ornithology, no 59, , p. 395-402.
- Emma McIntyre, Andrew G. Horn et Marty L. Leonard, « Do nestling Tree Swallows (Tachycineta bicolor) respond to parental alarm calls? », The Auk, vol. 131, no 3, , p. 314–320 (ISSN 1938-4254, DOI 10.1642/AUK-13-235.1, lire en ligne, consulté le )
- David W. Winkler, « Causes and Consequences of Variation in Parental Defense Behavior by Tree Swallows », The Condor, vol. 94, no 2, , p. 502–520 (ISSN 1938-5129, DOI 10.2307/1369222, lire en ligne, consulté le )
- (en-US) « Swallows – IOC World Bird List » (consulté le )
- United States National Museum, Bulletin of the United States National Museum, G.P.O, (lire en ligne)
- (en) IUCN, « Tachycineta bicolor: BirdLife International: The IUCN Red List of Threatened Species 2016: e.T22712057A94316797 », IUCN Red List, International Union for Conservation of Nature, (DOI 10.2305/iucn.uk.2016-3.rlts.t22712057a94316797.en, lire en ligne, consulté le )
- (en) Kelly K. Hallinger et Daniel A. Cristol, « The role of weather in mediating the effect of mercury exposure on reproductive success in tree swallows », Ecotoxicology, vol. 20, no 6, , p. 1368–1377 (ISSN 1573-3017, DOI 10.1007/s10646-011-0694-1, lire en ligne, consulté le )
- (en) « Patuxent Bird Identification and Breeding Bird Survey Results », sur www.mbr-pwrc.usgs.gov (consulté le ).
Liens externes
- (fr) Référence Oiseaux.net : Tachycineta bicolor (+ répartition)
- (en) Référence Congrès ornithologique international : (consulté le )
- (fr+en) Référence Avibase : Tachycineta bicolor (+ répartition)
- (fr) Référence CITES : taxon Tachycineta bicolor (sur le site du ministère français de l'Écologie) (consulté le )
- (en) Référence Fauna Europaea : Tachycineta bicolor (Vieillot, 1807) (consulté le )
- (en) Référence Animal Diversity Web : Tachycineta bicolor
- (en) Référence NCBI : Tachycineta bicolor (taxons inclus)
- (en) Référence UICN : espèce Tachycineta bicolor Vieillot, 1808 (consulté le )
