Helma Wennemers
Helma B. Wennemers, née le à Offenbach-sur-le-Main, est une chimiste allemande spécialiste de la chimie organique et peptidique. Elle est professeur de chimie organique à l'École polytechnique fédérale de Zurich.

| Naissance | |
|---|---|
| Activités |
| A travaillé pour | |
|---|---|
| Distinctions |
Médaille Inhoffen (d) () Membre de l'AAAS () Vincent du Vigneaud Award (d) () |
Biographie
Helma Wennemers a étudié la chimie à l'université de Francfort où elle a obtenu le diplôme des sciences chimiques avec Gehrhard Quinkert en 1993. De 1993 à 1996 elle a effectué sa thèse de doctorat dans le groupe de W. Clark Still à l'université Columbia de New York. Elle a ensuite rejoint le laboratoire de Hisashi Yamamoto à l'université de Nagoya pour un séjour post-doctoral. En 1999, elle a accepté une position de professeure adjointe à l'université de Bâle et, en 2003, elle a été nommée professeur agrégé au sein de cette même université[1]. En 2011 elle a été promue professeur titulaire de chimie organique à l'ETH Zurich.
Recherche
La recherche scientifique de Helma Wennemers se concentre sur la chimie organique, s'inspirant des systèmes biologiques en mettant l'accent sur des peptides ou protéines riches en prolines et d'un point de vue appliqué a des applications dans le domaine de la détection et du traitement du cancer[2] - [3]. Ses découvertes lui valent le prix Pedler de la Royal Society of Chemistry en 2016. Elle est la première femme, ainsi que la deuxième scientifique suisse à recevoir cette distinction[4].
Catalyse asymétrique
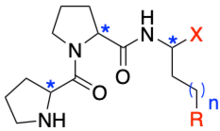
Wennemers a développé des tripeptides de la séquence H-Pro-Pro-Xaa (Pro: Proline, Xaa: n'importe quel acide aminé) comme organocatalyseur pour la formation de liaisons carbone-carbone basé sur un mécanisme énamine[5]. En variant soit la configuration absolue des acides aminés soit le groupe fonctionnel du résidu Xaa, il est possible d'obtenir une réactivité élevée, ainsi qu'une stéréosélectivité et une chimiosélectivité élevées autant pour les réactions d'aldolisation[6] que pour les réactions d'addition de Michael[7] - [8]. Grâce à la modularité des peptides, ce catalyseur peut catalyser des réactions d'addition de Michael d'un aldéhyde et d'une nitro-oléfine utilisant seulement 0.05% en moles de catalyseur tripeptidique[9]. C'est la quantité la plus basse d'organocatalyseur jamais utilisée pour une réaction de formation liaison C-C catalysée par une amine secondaire. Wennemers a également travaillé sur d'autres transformations catalysées par des catalyseurs organiques.
Inspiré par le mécanisme des polycétides synthases naturelles, qui utilisent les thioesters de l'acide malonique (MAHTs, par ex. Malonyl-CoA) comme équivalent d'un énolate de thioester, son groupe a développé des méthodes organocatalytiques pour les transformations stéréosélectives de MAHTs (ainsi que des variations protégées des monothiomalonates, MTMs) avec des électrophiles en utilisant des catalyseurs dérivés des alcaloïdes de Cinchona.
L'utilisation des MAHTs ou MTMs fluorés représente une méthode efficace pour installer de manière stéréosélective des substituants de fluor dans les réactions d'aldol avec des fluoroacétates ainsi que pour les réactions d'addition avec des imines[10] - [11] - [12].
Biologie chimique
Au niveau de la chimie biologique Wennemers utilise des peptides riches en prolines comme mimétique peptidique du collagène ou des oligoprolines pour l'utilisation dans le secteur du ciblage de tumeurs, du transport au travers de la membrane cellulaire ou pour délivrer des médicaments[13] - [14].
Wennemers utilise des dérivés de proline fonctionnalisés au niveau du carbone γ pour moduler la structure et la stabilité des triples hélices du collagène à chaine courte. En outre, Wennemers a installé aminoproline[15] et γ-azaproline[16] pour contrôler la stabilité conformationnelle de la triple hélice de collagène en fonction du pH.
Dans le secteur des peptides utilisés pour la pénétration des cellules, elle a démontré que la préorganisation des résidus cationiques le long de la chaine principale d'un oligoproline augmente la pénétration cellulaire de ces peptides dans des cellules cancéreuses par rapport aux oligoarginines avec une structure beaucoup plus flexible et sans arrangement défini des charges[14]. Ces CPPs basés sur des oligoprolines se localisent à l'intérieur du noyau cellulaire, et présentent une stabilité protéolytique élevée ainsi qu'une faible toxicité.
Matériaux synthétiques
Wennemers utilise des peptides pour contrôler la morphologie de matériaux nanostructurés pour fabriquer des systèmes mésoscopiques et macroscopiques hautement ordonnés. Son groupe a développé des tripeptides pour la synthèse contrôlée de nanoparticules d'argent, de palladium, de platine et d'or qui sont dispersives et solubles dans l'eau[17]. Très récemment elle a démontré que les nanoparticules de platine stabilisées par des peptides affichent une toxicité plus élevée envers les cellules hépatiques cancéreuses (HepG2) qu'envers d'autres cellules cancéreuses ou des cellules non-cancéreuses[18] - [19]. Wennemers s'intéresse également à l'analyse des conjugués d'oligoprolines en combinaison avec des systèmes π-conjugés qui forment des structures avec des morphologies diverses (par exemple des nanofibres, nanotubes, nanocouches). Avec ce type de conjugués elle a réussi à former le premier exemple d'un lacis tissé de manière triaxiale stabilisé par des interactions non covalentes faibles[20] - [21].
Récompenses
- Prix Leonidas Zervas de la European Peptide Society (2010)[22]
- prix Pedler de la Royal Society of Chemistry (2016)[23]
- Médaille Inhoffen (2017)[24]
- Prix néerlandais Scholar de la chimie supramoléculaire (2019)[25]
Notes et références
- (de) « Helma Wennemers erhält Leonidas Zervas Award », sur www.chemie.de (consulté le )
- (de) « Mit Platin-Nanopartikel gegen Leberkrebs », sur AerzteZeitung.de, (consulté le )
- (en) Celia Henry Arnaud, « Visualizing cross-linking in collagen », sur cen.acs.org, (consulté le )
- (en) « Prof. Helma Wennemers wins the 2016 Pedler Award », sur chab.ethz.ch (consulté le )
- H. Wennemers: In: Chem.
- P. Krattiger, R. Kovasy, J. D. Revell, S. Ivan, H. Wennemers, Org. Lett, 2005, 7, 1101–1103.
- M. Wiesner, J. D. Revell, H. Wennemers, Angew. Chem. Int., 2008, 47, 1871–1874.
- M. Wiesner, M. Neuburger, H. Wennemers, Chem. Eur. J. 2009, 15, 10103–10109.
- T. Schnitzer, H. Wennemers, J. Am. Chem. Soc., 2017, 139, 15356–15362.
- J. Saadi, H. Wennemers, Nature Chem., 2016, 8, 276–280.
- E. Cosimi, O. D. Engl, J. Saadi, M.-O. Ebert, H. Wennemers, Angew. Chem. Int., 2016, 55, 13127–13131.
- E. Cosimi, J. Saadi, H. Wennemers, Org. Lett., 2016, 18, 6014–6017.
- C. Kroll, R. Mansi, F. Braun, S. Dobitz, H. Maecke, H. Wennemers, J. Am. Chem. Soc., 2013, 135, 16793–16796.
- Y. A. Nagel, P. S. Raschle, H. Wennemers, Angew. Chem. Int., 2017, 56, 122–126.
- C. Siebler, R. S. Erdmann, H. Wennemers, Angew. Chem. Int., 2014, 53, 10340 – 10344.
- M. R. Aronoff, J. Egli, M. Menichelli, H. Wennemers, Angew. Chem. Int., 2019, 58, 3143–3146.
- S. Corra, M. S. Shoshan, H. Wennemers, Curr. Opin., Chem. Biol., 2017, 40, 138–144.
- M. S. Shoshan, T. Vonderach, B. Hattendorf, H. Wennemers, Angew. Chem. Int., 2019, 58, 4901–4905.
- « Therapie-Idee: Mit Platin-Nanopartikel gegen Leberkrebs », sur www.aerztezeitung.de (consulté le )
- U. Lewandowska, W. Zajaczkowski, S. Corra, J. Tanabe, R. Borrmann, E. M. Benetti, S. Stappert, K. Watanabe, N. A. K. Ochs, R. Schaeublin, C. Li, E. Yashima, W. Pisula, K. Müllen, H. Wennemers, Nat. Chem., 2017, 9, 1068–1072.
- Stu Borman, « Chemists weave most complex pattern yet made from organic threads | July 31, 2017 Issue - Vol. 95 Issue 31 | Chemical & Engineering News », sur cen.acs.org (consulté le )
- (en-US) Ruczynski |, « Leonidas Zervas Award », sur European Peptide Society, (consulté le )
- « RSC Pedler Award Previous Winners », sur www.rsc.org (consulté le )
- (en) « Inhoffen Medal », sur Helmholtz Centre for Infection Research (consulté le )
- « The Netherlands Award for Supramolecular Chemistry – FMS Research Center », sur fmsresearch.nl (consulté le )
Liens externes
- Ressources relatives à la recherche :
- (en) Dimensions
- (en) ORCID
- Site du groupe de travail Wennemers