Glycylglycine
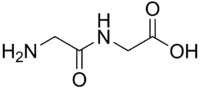
La glycylglycine est le dipeptide de glycine, ce qui fait d'elle le dipeptide le plus simple[4]. Ce composé a été synthétisé pour la première fois en 1901 par Emil Fischer et Ernest Fourneau[5], par ébullition de glycine anhydride (2,5-dioxopipérazine) avec de l'acide chlorhydrique[6]. Depuis lors, un procédé par composition avec une base[7] et d'autres méthodes de synthèse ont été publiés[8]. La glycylglycine est elle-même utilisée dans la synthèse de peptides plus complexes[9].
| Glycylglycine | |
| |
| Identification | |
|---|---|
| Nom UICPA | glycylglycine |
| Synonymes |
Gly-Gly, diglycine, |
| No CAS | |
| No ECHA | 100.008.299 |
| No CE | 209-127-8 |
| PubChem | 11163 |
| ChEBI | 17201 |
| SMILES | |
| InChI | |
| Apparence | Cristaux blancs |
| Propriétés chimiques | |
| Formule | C4H8N2O3 [Isomères] |
| Masse molaire[1] | 132,117 9 ± 0,005 1 g/mol C 36,36 %, H 6,1 %, N 21,2 %, O 36,33 %, |
| pKa | 3,133 |
| Propriétés physiques | |
| T° fusion | 262 à 264 °C[2] (décomposition) |
| Précautions | |
| SGH[3] | |
 Attention |
|
| Unités du SI et CNTP, sauf indication contraire. | |
En raison de sa faible toxicité, la glycylglycine est utile comme tampon pour les systèmes biologiques à des pH situés entre 2,5-3,8 et 7,5-8,9[10], toutefois sa relative instabilité en solution en rend la conservation difficile[11].
La glycylglycine a également été utilisée pour solubiliser des protéines recombinantes chez E. coli. Après son adjonction à différentes concentrations, on a pu constater une amélioration de la solubilité de ces protéines après la lyse cellulaire[12].
Bibliographie
- (en) Victor von Richter, Richard Anschütz (éd.) et Georg Shroeter (éd.) (trad. Edgar Fahs Smith et Percy Edwin Spielmann), Organic Chemistry or Chemistry of the Carbon Compounds [« Chemie der Kohlenstoffverbindungen oder Organische Chemie »], vol. 1 : Chemistry of the Aliphatic Series, Londres ; Philadelphie, K. Paul, Trench, Trubner & Co ; P. Blakiston fils & Co, 1922-1923 (ISBN 978-1-160-71089-3, OCLC 12678040), p. 391.
- (en) Max S. Dunn, A. W. Butler et T. Deakers, « The Synthesis of Glycylglycine », Journal of Biological Chemistry, American Society for Biochemistry and Molecular Biology, vol. 99, no 1, , p. 217-220 (ISSN 0021-9258, lire en ligne [PDF], consulté le ).
- (en) Robert Henry Aders Plimmer et F. G. Hopkins (éd.), The Chemical Constitution of the Proteins, Londres, Longmans, Green and Co., coll. « Monographs on Biochemistry », (1re éd. 1908), 80 p. (ISBN 978-1-4097-9725-8, présentation en ligne), partie II, p. 22.
- (en) Marshall E. Smith et Lynwood B. Smith, « Piperazine Dihydrochloride and Glycylglycine as Non-Toxic Buffers in Distilled Water and Sea Water », The Biological Bulletin, vol. 96, no 3, , p. 233-237 (ISSN 0006-3185, lire en ligne, consulté le ).
- (en) S. Ghosh, S. Rasheedi, S. S. Rahim, S. Banerjee, R. K. Choudhary, P. Chakhaiyar, N. Z. Ehtesham, S. Mukhopadhyay et S. E. Hasnain, « Method for Enhancing Solubility of the Expressed Recombinant Proteins in Escherichia coli », BioTechniques, vol. 37, no 3, , p. 418-423 (PMID 15470897)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Glycylglycine » (voir la liste des auteurs).
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Glycylglycine » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 3 octobre 2013 (JavaScript nécessaire)
- Richter, 1923.
- (de) « Ueber einige Derivate des Glykocolls », Berichte der deutschen chemischen Gesellschaft, vol. 34, , p. 2868-2877 (DOI 10.1002/cber.190103402249).
- Plimmer, 1908.
- Richter, 1923.
- Dunn et al., 1932
- (en) Suzan Budavari (éd.), The Merck Manual, Rahway (New Jersez), Merck & Co., , 11e éd., 1601 p. (ISBN 0-911910-28-X et 978-0-911910-28-5), p. 707-708.
- (en) « Biological Buffers », Sigma-Aldrich, (consulté le ).
- Smith et Smith, 1949.
- Ghosh et al., 2004.