Fluorure de vanadium(III)
Le fluorure de vanadium (III) est un composé chimique de formule VF3. Ce solide vert-jaune est obtenue en deux étapes de synthèse à partir de l'oxyde de vanadium V2O3[6]. Comme les autres fluorures de métaux de transition (par exemple le fluorure de manganèse), il possède un ordre magnétique à basse température (par exemple, pour V2F6.4H2O la température critique est 12 K[7].
| Fluorure de vanadium (III) | |
| |
| __ V3+ __ F− | |
| Identification | |
|---|---|
| Synonymes |
trifluorure de vanadium |
| No CAS | |
| No ECHA | 100.030.141 |
| PubChem | 66230 |
| SMILES | |
| InChI | |
| Apparence | poudre jaune-vert (anhydre) poudre verte(trihydrate)[1] - [2] |
| Propriétés chimiques | |
| Formule | VF3 |
| Masse molaire[3] | 107,936 7 ± 0,000 1 g/mol F 52,8 %, V 47,2 %, |
| Propriétés physiques | |
| T° fusion | 800 °C[2] |
| T° ébullition | 1 395 °C à 760 mmHg (anhydre)[1] 1 400 °C[2] |
| Solubilité | insol. in eau et éthanol[1] |
| Masse volumique | 3,363 g·cm-3[1] |
| Cristallographie | |
| Classe cristalline ou groupe d’espace | (no 167) [4] |
| Précautions | |
| SGH[5] | |
  |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Préparation
Dans une première étape, de l'hexafluorovanadate (III) d'ammonium est formé à partir d'oxyde de vanadium et de difluorure d'ammonium :
- V2O3 + 6 (NH4)HF2 → 2 (NH4)3VF6 + 3 H2O
Dans une seconde étape, l'hexafluorovanadate (III) d'ammonium est chauffé et se décompose comme suit :
- (NH4)3VF6 → 3 NH3 + 3 HF + VF3
La décomposition thermique des sels d'ammonium est une méthode assez commune pour générer des composés inorganiques.
VF3 peut également être formé par action de HF sur V2O3.
Propriétés
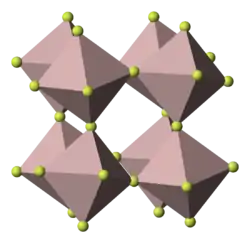
VF3 est un solide cristallin dans lequel les atomes de vanadium ont une coordinence de 6 et sont liés les uns aux autres par des atomes de fluor. L’existence d’un moment magnétique indique la présence d’électrons non appariés.
Structure
Le fluorure de vanadium (III) cristallise dans le système rhomboédrique (trigonal), groupe d'espace associé R3c (no 167) issu du groupe ponctuel 3 2/m avec comme paramètres de maille a = 517 pm, c = 1340,2 pm et α = β = 90°, γ = 120°[4].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Vanadium(III) fluoride » (voir la liste des auteurs).
- David R. Lide, CRC Handbook of Chemistry and Physics,90e ed., 2009, Boca Raton, Florida: CRC Press. (ISBN 978-1-4200-9084-0).
- Vanadium trifluoride sur webelements.com, consulté le 30/04/2017.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Bodie E. Douglas, Shih-Ming Ho, Structure and Chemistry of Crystalline Solids, New York, 2007, Springer Science+Business Media, Inc., p. 102. (ISBN 0-387-26147-8).
- Fiche Sigma-Aldrich du composé Vanadium(III) fluoride, consultée le 25 avril 2011. + (pdf) Fiche MSDS
- B. J. Sturm, C. W. Sheridan, Vanadium(III) Fluoride, Inorganic Syntheses, 1963, vol. 7, pp. 52-54.
- S. Nakhal et al., Z. Kristallogr., 2013, vol. 228, p. 347. DOI 10.1524/zkri.2013.1664.


