Fluorure d'or(V)
Le fluorure d'or(V), ou pentafluorure d'or, est un composé chimique de formule Au2F10, dans lequel l'or est à l'état d'oxydation +5, le plus élevé connu pour cet élément. Il s'agit d'un solide rouge soluble dans le fluorure d'hydrogène (HF), ce qui provoque sa décomposition avec libération de fluor F2.
| Fluorure d'or(V) | |
| |
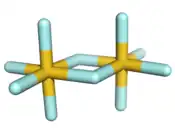
| Structure du fluorure d'or(V) | |
| Identification | |
|---|---|
| No CAS | |
| Propriétés chimiques | |
| Formule | Au2F10 |
| Masse molaire[1] | 583,917 17 ± 1,3E−5 g/mol Au 67,46 %, F 32,54 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
La molécule se présente comme un dimère centrosymétrique dans lequel l'or est hexacoordonné avec des atomes de fluor arrangés selon une géométrie octaédrique. C'est le seul pentafluorure dimérique connu, les autres étant soit monomériques (P, As, Cl, Br, I), tétramériques (Nb (en), Ta (en), Cr (en), Mo (en), W, Tc, Re, Ru, Os, Rh, Ir (en), Pt (en)), ou polymérique (Bi (en), V (en), U)[2].
On peut le préparer en chauffant de l'or dans une atmosphère d'oxygène O2 et de fluor F2 jusqu'à 370 °C sous une pression de 8 atm pour former de l'hexafluoroaurate de dioxygényle :
Ce sel se décompose à 180 °C en libérant le pentafluorure d'or :
Une réaction de décomposition semblable peut être obtenue à l'aide de difluorure de krypton KrF2, donnant un sel qui se décompose à 60 °C pour donner le fluorure d'or(V) :
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) In Chul-Hwang et Konrad Seppelt, « Gold Pentafluoride: Structure and Fluoride Ion Affinity », Angewandte Chemie International Edition, vol. 40, no 19, , p. 3690-3693 (PMID 11592224, DOI 10.1002/1521-3773(20011001)40:19<3690::AID-ANIE3690>3.0.CO;2-5, lire en ligne)