Dioxyde de soufre en œnologie
Le dioxyde de soufre (synonymes: anhydride sulfureux, SO2, sulfite, bisulfite, oxyde sulfureux) est un gaz de formule chimique SO2, c'est-à-dire qu'il comporte un atome de soufre et deux atomes d'oxygène[1].
C'est un additif alimentaire qui, du fait de ses propriétés, est largement utilisé en œnologie tout comme dans l'industrie agroalimentaire en général (fruits secs, charcuteries, moutarde, préparations culinaires pré-emballées, crustacés, céréales)[1] - [2] - [3] et dans l'industrie chimique.
Propriétés
Le dioxyde de soufre est utilisé en œnologie principalement du fait de ses différentes propriétés:
- antiseptique: il a une action contre le développement des microorganismes (sélection des microorganismes avant les fermentations, opposition au développement des microorganismes pendant la conservation (lutte contre le développement des bactéries lactiques, des bactéries acétiques, des levures (pouvant provoquer la refermentation des vins doux), des Brettanomyces (pouvant former des phénols volatils tels que le 4-éthylgaïacol) et des altérations bactériennes telles que les maladies de la graisse, de la tourne ou de l'amer)[4].
- antioxydant: il a une action de combinaison de l'oxygène dissous et permet notamment d'éviter - à l’extrême - la maderisation du vin. Il préserve les vins d'une oxydation trop intense des composés phénoliques et de certains éléments de l'arôme favorables au développement des qualités sensorielles au cours de la conservation. Cette propriété est à mettre en relation avec sa capacité à combiner l'éthanal, molécule produite dans le vin notamment en cas d'oxydation[4].
Par ailleurs, le dioxyde de soufre possède une activité antioxydasique (qui permet de diminuer l'activité d'enzymes naturelles du raisin et néfastes pour la qualité du vin, que sont la tyrosinase et la laccase) et une action de dilution des anthocyanes, molécules responsables de la couleur des vins rouges (cette dernière propriété n'est que très peu utilisée - voir macération sulfitique).
Utilisation
Histoire


Il semblerait que le dioxyde de soufre soit utilisé en œnologie depuis la fin du XVIIIe siècle[4].
Cas d'utilisation dans le vin
En œnologie l'anhydride sulfureux est utilisé lors des différentes phases de la vinification et de la conservation du vin[4].
Les moments choisis pour ces adjonctions varient d'un domaine à l'autre et dépendent des habitudes du vigneron ou du maître de chai, du type de vin élaboré, des choix techniques et de la qualité sanitaire de la vendange.
Ainsi un sulfitage pourra être effectué à ces différents moments:
- à la vendange
- à la réception de la vendange
- au pressurage
- à l'encuvage
- au mutage dans le cas des vins doux
- à la fin de la fermentation alcoolique
- à la fin de la fermentation malolactique
- durant l'élevage, la conservation et le stockage du vin
- avant le conditionnement
Quantités utilisées dans le vin
Les quantités de dioxyde de soufre ajoutées au raisin et au vin dépendent également des pratiques du producteur et des contraintes techniques liés aux produits élaborés.
Ainsi on retrouvera une concentration finale en dioxyde de soufre différente selon le type de vin auquel on a affaire. On peut considérer que cette concentration sera plus élevée dans un vin doux que dans un vin blanc sec, que dans un vin effervescent, que dans un vin rouge.
De manière générale les doses utilisées par ajout varient de 10 à 150 mg/L selon l'étape et le type de produit.
États dans le vin: SO2 moléculaire, libre, combiné, total
Le dioxyde de soufre ajouté dans le vin peut être présent sous différentes formes[4] ce qui a une influence sur son activité.
On peut schématiser ce phénomène ainsi :
- SO2 total = SO2 libre + SO2 combiné
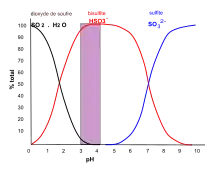
Le dioxyde de soufre SO2 gazeux réagit quasi instantanément avec l'eau suivant l'équilibre :
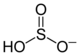
- SO2 + 2 H2O HSO3− + H3O+
Il se forme des ions hydronium H3O+ et des anions hydrogénosulfite HSO3− (ou bisulfite). Le SO2 en solution aqueuse est appelé « acide sulfureux ».
Un second équilibre s'établit avec l'hydrogénosulfite :
- HSO3− SO32− + H+
En solution aqueuse, il s'établit donc un équilibre entre le dioxyde de soufre en solution (le SO2 moléculaire), l'anion bisulfite (HSO3−) et l'ion sulfite (SO32−). En œnologie par convention, ces trois formes sont dites « dioxyde de soufre libre » ou « anhydride sulfureux libre ». L'équilibre entre ces formes dépend du pH. Ainsi pour un pH de 3-4, correspondant au vin, le bisulfite est l'espèce dominante[5]. Il résulte de ces notions que les propriétés antiseptiques, vis-à-vis des bactéries et des levures, d'une dose donnée "d'anhydride sulfureux libre" dépendent du pH. De même, comme on peut voir sur les courbes, l'odeur désagréable du SO2 gazeux (le SO2•H2O moléculaire) est d'autant plus importante que le vin est plus acide (pour une même valeur d'anhydride sulfureux libre).
Par ailleurs, les bisulfites possèdent la propriété remarquable de se fixer sur les molécules possédant un groupe carbonylé (aldéhyde ou cétone). Aussi les trouve-t-on à la fois sous forme libre et sous forme combinée (d'hydroxysulfonate). La liaison se fait principalement avec l'acétaldéhyde, les anthocyanosides, le pyruvate, le dihydroxyacétone, le glucose etc. Ainsi avec l'acétaldéhyde, on a la forme combinée bisulfite-aldéhyde :
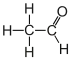
+ 
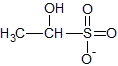
éthanal ion bisulfite acétaldéhyde bisulfite
L'acétaldéhyde bisulfite représente généralement la part la plus importante du SO2 combiné dans le vin[4]. La valeur extrêmement faible de la constante K correspond à une combinaison à 99 %. Donc dans le vin contenant du SO2 libre, la présence d'éthanal libre est supposée impossible.
On considère généralement[5] que la forme moléculaire du dioxyde de soufre est la forme antimicrobienne. La solution SO2.H2O n'ayant pas de charge, peut pénétrer dans la cellule et subir une dissociation au pH d'environ 6,5 du cytoplasme en bisulfite et sulfite.
L'espèce SO2 est apte à inhiber les microorganismes en rompant les ponts disulfures des protéines et en réagissant avec des cofacteurs comme le NAD+ et le FAD. Le SO2 peut aussi cliver la thiamine, rendant la vitamine inopérante.
Réglementation
Dose maximale dans l'Union européenne
Dans l'Union européenne c'est le règlement européen 1333/2008[6] qui régit de manière générale l'utilisation des additifs alimentaires et donc du dioxyde de soufre.
Dans le cas particulier de l’œnologie, le règlement européen 606/2009[7] énumère les pratiques œnoliques autorisés dans l'élaboration des vins.
Les vins rouges combinent une plus grande part de SO2 que les vins blancs, c'est pourquoi les doses autorisées y sont plus faibles.
Cas général
Les teneurs en dioxyde de soufre totales (SO2 Total) dans un vin commercialisé ne peuvent être supérieures à :
- 150 mg/L pour les vins rouges
- 185 mg/L pour les vins effervescents
- 200 mg/L pour les vins blancs et rosés
ou :
- 200 mg/L pour les vins rouges contenant plus de 5 g/L de glucose + fructose
- 250 mg/L pour les vins blancs et rosés contenant plus de 5 g/L de glucose + fructose
- 300 mg/L voire 400 mg/L dans le cas de certaines dénominations géographiques de vins doux ou liquoreux.
Il est à noter que ces doses sont rarement atteintes dans les vins. En France, les doses moyennes sont de 75 mg/L pour les vins rouges et de 105 mg/L pour les vins blancs[4].
Cas des vins produits selon les principes de l'agriculture biologique
Dans l'Union européenne, le règlement d’exécution 203/2012[8] légifère sur les pratiques œnologiques autorisés en vinification biologique.
L'utilisation de dioxyde de soufre dans les vins produits en agriculture biologique est réglementée ainsi :
- 100 mg/L pour les vins rouges ayant moins de 2 g/L de sucres résiduels
- 150 mg/L pour les vins blancs et rosés ayant moins de 2 g/L de sucres résiduels
- de 30 mg/L inférieure à la réglementation générale (règlement européen 606/2009) pour tous les autres types de vins.
Historique de la réglementation sur le dioxyde de soufre dans les vins
En France, en 1907, la dose maximale dans les vins était de 350 mg/L. En 1926, elle était de 450 mg/L[4].
En 1999, le règlement européen 1493/1999[9] a fixé les teneurs maximales à 160 mg/L pour les vins rouges secs et à 210 mg/L pour les vins blancs secs.
Formes d'utilisation en œnologie

Dans l'Union européenne, seules les formulations suivantes sont autorisées en œnologie[7] :
- Dioxyde de soufre sous forme gazeuse
- Bisulfite de potassium HKSO3
- Bisulfite d'ammonium NH4HSO3(cette forme n'est autorisée que sur moût ou sur moût en fermentation)
- Métabisulfite de potassium K2S2O5

La combustion de soufre fleur, aussi appelé mèche soufrée, conduisant à la formation du gaz, est particulièrement utilisée pour l’asepsie des contenants en bois.
Étiquetage
Pour les pays de l'Union européenne, depuis 2005, au-delà d'une teneur de 10 mg/L exprimée en SO2, l'étiquetage est obligatoire (dans la langue du pays de consommation).
En France, l'étiquette du vin doit mentionner « contient des sulfites » ou « contient du SO2 »[10]. Il est considéré comme un allergène.
À l'étranger, de nombreux pays requièrent cette mention, dans leur langue, pour les vins locaux ou importés.
Dioxyde de soufre et santé humaine
Le SO2 peut porter des dommages grave à la santé humaine. À l'état de gaz dissous, c'est-à-dire à l'état « libre », le SO2 est un corrosif pour les muqueuses de tous les organes qui subissent son contact ou en sont imprégnés[11]. Il peut y avoir une absorption par les muqueuses des voies respiratoires supérieures, puis un transfert dans le sang qui le transporte dans les organes. Les ions sulfites et bisulfites formés par sa dissolution peuvent endommager les tissus cellulaires[12]. L'Organisation mondiale de la santé (OMS) a fixé à 25 milligrammes la dose journalière admissible, sans préciser sous quel état.
L'anhydride sulfureux aurait des propriétés allergènes, notamment chez les personnes asthmatiques.
Cas des vins sans soufre
Un vin "sans soufre" est un vin élaboré sans ajout de sulfite. Le concept est fortement relayé médiatiquement du fait d'une prise de conscience des consommateurs dans le prolongement de la mouvance des vins biologiques et des vins biodynamiques. Cependant ce type de vin ne représente qu'une faible proportion des vins mis sur le marché.
Les principales limites à l'élimination complète des sulfites dans l'élaboration du vins sont des contraintes techniques (conditions de conservation, risques de refermentation ou d'altération, style aromatique recherché) au regard des exigences des consommateurs. On notera également le confort pour le producteur qui protège ainsi son produit des éventuelles altérations.
Techniquement un vin sans soufre ajouté est possible quand la conjonction de différents contraintes se rencontrent :
- maîtrise technique de la vinification
- moyens technologiques adaptés
- hygiène stricte, notamment vis-à-vis des contaminations de micro-organismes indésirables
- cépages et profils produits conformes au style induit par cette pratique
- conditions de stockage et de conservation contrôlées (température, durée)
Les risques d'un vin sans soufre ajoutés sont principalement l'oxydation, la refermentation, la piqûre acétique ou autres contaminations microbiologiques.
À noter que les levures produisent naturellement de 5 à 30 mg/L de SO2[4] lors de la fermentation. Aussi les vins sans sulfites ajoutés contiennent tout de même du SO2. Ils sont souvent soumis à l'étiquetage des allergènes.
Techniques courantes de dosage dans les vins
Les méthodes ci-dessous sont référencés par l’OIV (l’Organisation Internationale de la Vigne et du Vin). Les teneurs calculées sont en mg/L.
Méthode de Franz Paul
Le principe sur la distillation du dioxyde de soufre en milieu acide.
Après entraînement par un courant gazeux (d’air ou d’azote), le SO2 est fixé et oxydé par barbotage dans une solution diluée et neutre de H2O2[13]. L’acide sulfurique formé est dosé par acidimétrie dans une solution de NaOH. La méthode est capable d’extraire autant du SO2 libre par un courant froid d’environ 10 °C que du dioxyde de soufre total, et ce, par un courant chaud d’environ 100 °C.
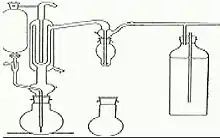
Cas du dioxyde de soufre libre
On insère dans le montage un ballon de 250 mL avec 50 mL d’échantillon + 15 mL de H3PO4. Dans le barboteur, on verse 2 à 3 mL de peroxyde et 2 gouttes du réactif indicateur. Puis, on neutralise avec 0,01 M de NaOH. Par la suite, on installe le barboteur à l’appareil et l’on fait barboter le courant gazeux pendant 15 minutes. Le dioxyde de soufre libre s’oxydera en acide sulfurique pour être tout à la fin titré de la même façon.
Cas du dioxyde de soufre total
Si la teneur est supérieure à 50 mg/L, on utilisera 20 mL d’échantillon auquel seront ajoutés 5 mL de H3PO4. Le mélange est amené dans le barboteur et neutralisé. Il sera porté à ébullition et on le maintiendra pendant le passage du courant gazeux. Puis, on effectue le dosage acidimétrique avec 0,01 M de NaOH.
Méthode de Ripper
C’est une méthode usuelle qui se base sur l’oxydation du vin en milieu acide. Le dosage directement sur le vin (SO2 libre) se fait par titrage iodométrique.
Cas du dioxyde de soufre libre
Dans un erlenmeyer de 500 mL, on ajoute 50 mL de vin, 5 mL de l’indicateur d’amidon, 30 mg d’EDTA auquel on ajoute 3 mL d’acide sulfurique. Le mélange est ensuite titré avec la solution d’iode à 0,025 M.
Cas du dioxyde de soufre total
- Pour évaluer la décombinaison lié à l’éthanal : au mélange précédent, on ajoute 8 mL de solution de NaOH 4 M. On agite une seule fois et on laisse reposer pour libérer le SO2. Par la suite, on verse ce mélange dans une fiole qui contenait au départ 10 mL d’H2SO4 au 1/10. On titre avec la solution d’iode précédente en employant l’indicateur d’amidon.
- Pour évaluer la décombinaison totale du SO2 lié aux autres constituants du vin : on ajoutera au même mélange 20 mL de la solution de NaOH 4 M. On agite une seule fois et on laisse reposer, on dilue avec 200 mL d’eau froide et on verse d’un seul coup comme précédemment 30 mL d'H2SO4 au 1/10. On titre avec la solution d’iode 0,025 M en employant l’indicateur d’amidon.
Soufre en viticulture
Le soufre (soufre fleur ou soufre mouillable) utilisé en poudrage ou en pulvérisation lors du soufrage de la vigne au cours du cycle végétatif n'a aucun lien avec les concentrations en anhydride sulfureux des vins.
Notes et références
- (fr)Air Liquide - Encyclopédie des gaz - SO2
- (fr)Radio Canada - Émission l'Epicerie - Réactions
- (fr)Le Figaro Santé - La crevette
- Pascal Ribéreau-Gayon et al., Traité d'Œnologie Tome 1: Microbiologie du vin, Vinifications, Dunod, 2004 (ISBN 2-1000-7301-X)
- (en) Kenneth C. Fugelsang et Charles Edwards, Wine Microbiology : Practical Applications and Procedures, Springer-Verlag, New York Inc., , 2e éd., 394 p. (ISBN 978-0-387-33341-0 et 0-387-33341-X, lire en ligne)
- (fr) Règlement européen 1333/2008.
- (fr) Règlement européen 606/2009.
- (fr) Règlement d’exécution 203/2012.
- (fr) Règlement européen 1493/1999.
- (fr) Directive 2003/89/CE du Parlement et du Conseil européen du 10 novembre 2003.
- Max Léglise (1994) p. 69.
- Voir sur sante.lefigaro.fr.
- Bondet Chantal et Raymond Sylvestre, Pratiquer les contrôles en œnologie, Paris, Educagri, 2005 p. 137
Voir aussi
Bibliographie
- Chandon, J. A. (2005) Faites votre vin Encyclopédie d’Utovie, 50 p.
- Chang-Ricard, B. (2009) Micro Vino. Faire mon vin dans mon jardin Bordeaux : Confluences, 98 p.
- Chervin, C. (2006) Je fais mon vin Paris : Hachette 127 p.
- De Brouwer, M. (1998) Traité de vinification (2eed. 2004) Bruxelles : CEPvdqa Éditeur, 242 p.
- Dubourg, V. & J. (2009) Comment fait-on le vin ? Mémo Gisserot, Plouédem : J. P. Gisserot Éditions, 66 p.
- Gianadda, P. A. (2012) Tout savoir pour faire son propre vin Lausanne : Éditions Favre, 130 p.
- Le Bihan, J. C. (2011) Cultiver sa treille bio et réussir vin, jus, confitures, Mens : Éditions terre Vivante, 162p.
- Léglise, M. (1994) Les méthodes biologiques appliquées à la vinification et à l'œnologie Ed. Le Courrier du livre, tome 1, 170 p.
Articles connexes
Lien externe
- Collectif, Maîtrise du sulfitage des moûts et des vins, Les cahiers itinéraires d'ITV France, n° 3, , 20 p. (lire en ligne [PDF]).
