Difluorosilane
Le difluorosilane est un composé chimique de formule SiH2F2. Il se présente sous la forme d'un gaz incolore[1] dont le point d'ébullition, de −77,8 °C, est le plus élevé des fluorosilanes[3]. Il se décompose aux températures supérieures à environ 450 °C pour former du trifluorosilane SiHF3, du tétrafluorure de silicium SiF4 ainsi que d'autres composés[4].
| Difluorosilane | |
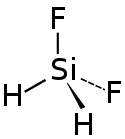
| |
| Structure du difluorosilane | |
| Identification | |
|---|---|
| No CAS | |
| PubChem | 123331 |
| SMILES | |
| InChI | |
| Apparence | gaz incolore[1] |
| Propriétés chimiques | |
| Formule | SiH2F2 |
| Masse molaire[2] | 68,098 2 ± 0,000 4 g/mol H 2,96 %, F 55,8 %, Si 41,24 %, |
| Propriétés physiques | |
| T° fusion | −122 °C[1] |
| T° ébullition | −77,8 °C[1] |
| Masse volumique | 2,783 g·L-3[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
Le difluorosilane peut être obtenu en faisant réagir du dichlorosilane SiH2Cl2 avec du trifluorure d'antimoine SbF3[5] :
Cette réaction libère également du tétrafluorure de silicium SiF4 avec de l'hydrogène H2[6].
Soumis à un arc électrique, les atomes d'hydrogène sont éliminés préférentiellement de la molécule SiH2F2, ce qui libère de l'hydrogène H2 en donnant du 1,1,2,2-tétrafluorodisilane F2HSi–SiHF2[5] :
- 2 SiH2F2 ⟶ SiHF2SiHF2 + H2.
À température élevée, le difluorosilane peut se dismuter en échangeant un atome d'hydrogène et un atome de fluor entre deux molécules, ce qui donne du fluorosilane SiHF3 et du trifluorosilane SiHF3[7].
Le difluorosilane peut être utilisé avec l'ammoniac NH3 pour le dépôt chimique en phase vapeur (CVD) de couches minces de nitrure de silicium Si3N4[8].
Notes et références
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, 93e éd, CRC Press, 2016, p. 87. (ISBN 978-1-4398-8050-0)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) E. A. V. Ebsworth, Volatile Silicon Compounds International Series of Monographs on Inorganic Chemistry, Elsevier, 2013, p. 54. (ISBN 978-1-4831-8055-7)
- (en) Theodore M. Besmann, Proceedings of the Thirteenth International Conference on Chemical Vapor Deposition, The Electrochemical Society, 1996, p. 203. (ISBN 978-1-56677-155-9)
- (en) C. C. Addison, Inorganic Chemistry of the Main-Group Elements, Royal Society of Chemistry, 1973, p. 188. (ISBN 978-0-85186-752-6)
- (en) Advances in Inorganic Chemistry and Radiochemistry, Academic Press, 1964, p. 167. (ISBN 978-0-08-057855-2)
- (en) E. A. V. Ebsworth, Volatile Silicon Compounds: International Series of Monographs on Inorganic Chemistry, Elsevier, 2013, p. 54-56. (ISBN 978-1483180557)
- (en) Nobuaki Watanabe, Mamoru Yoshida, Yi-Chao Jiang, Tutomu Nomoto Tutomu Nomoto et Ichimatsu Abiko Ichimatsu Abiko, « Preparation of Plasma Chemical Vapor Deposition Silicon Nitride Films from SiH2F2 and NH3 Source Gases », Japanese Journal of Applied Physics, vol. 40, no 4A, , L619-L621 (DOI 10.1143/JJAP.30.L619, Bibcode 1991JaJAP..30L.619W, lire en ligne)