Corbicula fluminalis
Corbicula fluminalis communément nommée corbicule asiatique ou palourde asiatique (comme C. fluminea qui lui ressemble), est l'une des nombreuses espèces de corbicules (mollusque bivalve d'eau douce))[1].

Ce filtreur se nourrit principalement du phytoplancton qu'il prélève dans l'eau. Il résiste relativement bien à la pollution, mais nécessite une eau courante pour bien se développer.
Il serait plus vulnérable au gel (à la congélation) que l'espèce proche et sympatrique[2] C. fluminea.




Écologie, habitat
On trouve cette espèce de bivalve filtreur et fouisseur dans les eaux douces (à saumâtres) dans divers types de sédiments : limon, sable, argile, gravier. Les coquilles des adultes morts contribuent à produire un sable coquiller.
Histoire, préhistoire
C'est l'une des espèces de mollusque qui a été consommée par l'homme ou peut encore l'être en Chine.
Des formes fossiles en sont connues en Europe, dont dans certains dépôts interglaciaires[3].
Espèces envahissante ou invasive
Lors du processus de mondialisation de l'économie, ce mollusque d'origine asiatique s'est récemment rapidement et largement répandu le long des voies du commerce international[4] et dans de nombreux fleuves et cours d'eau des pays où il a été introduit par les activités humaines (en Amérique, Europe et jusqu'en Afrique du Sud[5]) et la mise en relation de bassins versants différents par les réseaux de canaux, devenant invasive, notamment grâce à la capacité qu'ont les larves à se faire emporter par le courant, capacité qui persiste chez les jeunes corbicules capables d'utiliser leur siphon et de sécréter un mucus invisible qui joue le rôle de bouée et de voile les emportant dans courant[6].
Là où les corbicules pullulent, comme d'autres filtreurs invasifs[7] elle peut être source d'une réduction significative du phytoplancton en suspension comme cela a été montré dans le Potomac[8] - [9]
Description
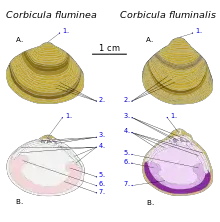
La coquille est comme chez tous les corbicules globalement triangulaire, mais plus petite chez l'adulte que chez Corbicula fluminea (24 mm contre plus de 30 mm chez C. fluminea dans le centre de la France).
La surface interne de la coquille est blanche à rosée
Les siphons ont des ouvertures circulaires et étroites[1].
L'espèce peut être difficile à distinguer de certaines autres espèces proches (il faut alors se référer aux morphotypes mais aussi observer des caractères plus discrets tels que la taille moyenne des spermatozoïdes, la pigmentation des siphons, voire à la génétique et à la phylogénie moléculaire...)[1]
Durée de vie
Une marque de croissance est produite sur la coquille chaque année.
On considère qu'il ne vit pas plus de 4 ans en France (comme C. fluminea[10]) mais en Chine, dans la Rivière des perles, près de Canton (province du Guangdong), on estime qu'il peut vivre environ 10 ans alors que Corbicula fluminea (Müller, 1774) n'y vivrait selon Morton (1982) que 3 ans environ[11] mais en se reproduisant deux fois par an[11].
Reproduction
Les spermatozoïdes sont libérés dans l'eau puis récupérés par un autre individu lors du processus de filtration de l'eau.
La fécondation a lieu et les zygotes grandissent dans les chambres d'incubation de la cavité branchiale, au niveau des hémibranchies des adultes[1]. Les larves sont ensuite expulsées dans le milieu. Pédivéligères, elles rampent plus qu'elles ne nagent[10]. La plupart d'entre elles seront rapidement mangées par des organismes planctonivores.
Dans une population importante, on trouve toujours quelques individus hermaphrodites (avec un testicule présent dans la partie antérieure et simultanément un ovaire dans la partie postérieure de l'animal).
Stratégie de reproduction : elle semble combiner une fécondité élevée qui compense une mortalité très élevée en phase planctonique. Une étude[11] faite en Chine sur la stratégie sexuelle de cette espèce a conclu que ce mollusque nait dioïque, devenant mâle ou femelle lors de sa première année, mais qu'il existe aussi environ 4,5 % des individus ambisexuels (l'étude ne précisant pas si ces cas sont toujours naturels ou pourraient aussi résulter d'un phénomène d'imposex induit par la pollution de l'eau par des perturbateurs endocriniens)[11]. On a noté chez la plupart des spécimens dioïque une tendance générale à un hermaphrodisme protogyne consécutif. « Ainsi, environ 60 % de tous les jeunes individus (0 à un an) sont femelles, ce taux diminuant ensuite avec l'âge » (à 60 % des individus de 0 à 8 ans, sont des mâles)[11]. Cette variabilité de la stratégie sexuelle pourrait être une des explications à la remarquable adaptabilité de cette espèce à des conditions environnementales variée, mais on ignore encore si le pourcentage croissant de mâles quand une cohorte vieillit ne traduit pas aussi une mortalité plus importante chez les femelles. L'écologie de l'espèce semble similaire en Chine du Sud et au Japon où l'espèce fraye une fois par an quand la température de l'eau est la plus basse (en novembre - décembre)[11].
Morton signale aussi que des glandes se développent dans les hémibrancies des cténidies des jeunes individus, puis sont moins souvent trouvées avec l'âge. La fonction des glandes est mal comprises[11]. Selon lui, chez cette espèce, les œufs fécondés sont pas incubées dans les cténidies.
Période de reproduction : Elle semble pouvoir varier selon le climat de la région où l'espèce vit naturellement ou a été introduite.
Un suivi fait pour deux espèces de Corbicules (C. fluminalis et C. fluminea) dans canaux dans le centre de la France (de décembre 2001 à mai 2003) a montré[12] que les populations de C. fluminalis sont dans cette région caractérisées par deux temps de reproduction, légèrement différents de ce qu'ils sont chez C. fluminea : une première période, hivernale est caractérisée par un faible nombre de larves. Elle est suivie d'une seconde période qui s'étend sur près de 10 mois (mars-octobre), avec un pic d'intensité en juin-juillet, perdurant éventuellement jusqu'en décembre[12].
Dans l'année, quatre cohortes apparaissent. La longévité des individus est de quatre ans, avec alors une longueur maximale de 24 mm (contre 36 pour C. fluminea). La croissance de la coquille est plus lente que chez C. fluminea et l'espèce se montre plus sensible à la congélation.
Une baisse brutale de la teneur du milieu en chlorophylle peut induire une période de frai et d'incubation chez ces deux corbicules[12].
Toxicologie
Cette espèce comme tous les organismes filtreurs peut, dans certaines conditions, accumuler des toxines d'origine bactérienne ou planctonique.
Elle peut aussi bioaccumuler des métaux lourds (mercure probablement notamment si l'on se réfère à l'espèce proche C. fluminea[13].
Notes et références
Références taxonomiques
- (en) Référence Catalogue of Life : Corbicula fluminalis (O. F. Müller, 1774) (consulté le )
- (fr+en) Référence ITIS : Corbicula fluminalis (O. F. Müller, 1774)
- (en) Référence NCBI : Corbicula fluminalis (taxons inclus)
- (en) Référence UICN : espèce Corbicula fluminalis (O.F. Müller, 1774) (consulté le )
- (en) Référence World Register of Marine Species : espèce Corbicula fluminalis (O. F. Müller, 1774)
Notes et autres références
- Korniushin, A. V. (2004) A revision of some Asian and African freshwater clams assigned to Corbicula fluminalis (Müller, 1774)(Mollusca: Bivalvia: Corbiculidae), with a review of anatomical characters and reproductive features based on museum collections. Hydrobiologia, 529(1-3), 251-270. (résumé) ; étude basée sur des spécimens du genre Corbicula(Müller, 1774) provenant de la partie asiatique occidentale de l'aire de répartition (Moyen-Orient, Caucase et Asie centrale) de ce genre.
- Ciutti, F., & Cappelletti, C. (2009). First record of Corbicula fluminalis (Müller, 1774) in Lake Garda (Italy), living in sympatry with Corbicula fluminea (Müller, 1774). Journal of limnology, 68(1), 162-165.
- Kerney M.P (1971) Interglacial deposits in Barnfield pit, Swanscombe, and their molluscan fauna. Journal of the Geological Society, 127(1), 69-93 (résumé)
- Karatayev, A. Y., Padilla, D. K., Minchin, D., Boltovskoy, D., & Burlakova, L. E. (2007). Changes in global economies and trade: the potential spread of exotic freshwater bivalves. Biological Invasions, 9(2), 161-180.
- De Kock K & Wolmarans C (2007) Distribution and habitats of Corbicula fluminalis africana (Mollusca: Bivalvia) in South Africa. Water Sa, 33(5), 709-716.
- Prezant RS & Chalermwat K (1984) « Flotation of the bivalve Corbicula fluminea as a means of dispersal ». Science, 225, 1491-1493. PDF, 3 pp
- Darrigran G (2002) Potential impact of filter-feeding invaders on temperate inland freshwater environments. Biological Invasions 4, 145e156.
- Cohen RR, Dresler PV, Phillips EJ & Cory RL (1984) The effect of the Asiatic clam, Corbicula fluminea, on phytoplankton of the Potomac River, Maryland. Limnology and Oceanography, 29(1), 170-180 (PDF, 11p)
- Phelps, H. L. (1994). « The Asiatic clam (Corbicula fluminea) invasion and system-level ecological change in the Potomac River estuary near Washington, DC ». Estuaries, 17(3), 614-621 (https://link.springer.com/article/10.2307/1352409 résumé]).
- Dewarumez J.-M., Gevaert F., Massé C., Foveau A., Grulois D., 2011. Les espèces marines animales et végétales introduites dans le bassin Artois-Picardie. UMR CNRS 8187 LOG et Agence de l’Eau Artois-Picardie. PDF, 140 pages
- Morton B (1982) Some aspects of the population structure and sexual strategy of Corbicula cf. fluminalis (Bivalvia: Corbiculacea) from the Pearl River, People's Republic of China. Journal of Molluscan Studies, 48(1), 1-23 (résumé).
- Mouthon J & Parghentanian T (2004) "Comparison of the life cycle and population dynamics of two Corbicula species, C. fluminea and C. fluminalis (Bivalvia: Corbiculidae) in two French canals". Archiv für Hydrobiologie, 161(2), 267-287.résumé)
- Inza B, Ribeyre F, Maury-Brachet R, Boudou A. 1997. « Tissue distribution of inorganic mercury, methylmercury and cadmium in the Asiatic clam (Corbicula fluminea) in relation to the contamination levels of the water column and sediment ». Chemosphere 35, 2817-2836
Voir aussi
Articles connexes
Bibliographie
- Kinzelbach R (1992) The distribution of the freshwater clam Corbicula fluminalis in the Near East (Bivalvia: Corbiculidae). Zoology in the Middle East, 6(1), 51-62 (résumé).
- Meister A (1997) Lebenszyklus, Autökologie und Populationsökologie der Körbchenmuscheln Corbicula fluminea und Corbicula fluminalis (Bivalvia, Corbiculidae) im Inselrhein. Hessische Landesanst. für Umwelt.
- Morton B (1982) Some aspects of the population structure and sexual strategy of Corbicula cf. fluminalis (Bivalvia: Corbiculacea) from the Pearl River, People's Republic of China. Journal of Molluscan Studies, 48(1), 1-23 (résumé).
- Paunović M, Csányi B, Knežević S, Simić V, Nenadić D, Jakovčev-Todorović D, ... & Cakić P (2007) Distribution of Asian clams Corbicula fluminea (Müller, 1774) and C. fluminalis (Müller, 1774) in Serbia. Aquatic Invasions, 2(2), 99-106.
- Rajagopal, S., Van der Velde, G., & De Vaate, A. B. (2000). Reproductive biology of the Asiatic clams Corbicula fluminalis and Corbicula fluminea in the river Rhine. Archiv für Hydrobiologie, 149(3), 403-420 (résumé).
- Skuza L, Łabęcka A.M & Domagała J (2009) Cytogenetic and morphological characterization of Corbicula fluminalis (OF Müller, 1774)(Bivalvia: Veneroida: Corbiculidae): taxonomic status assessment of a freshwater clam. Folia biologica, 57(3-4), 177-185 (résumé).
