Cofacteur F430
Le cofacteur F430 est le groupement prosthétique de la méthyl-coenzyme M réductase, une enzyme intervenant à la dernière étape de la méthanogenèse chez les archées méthanogènes pour libérer le méthane :
| Cofacteur F430 | |
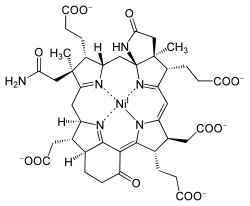 Structure du cofacteur F430 |
|
| Identification | |
|---|---|
| No CAS | |
| PubChem | 5460020 |
| ChEBI | 28265 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C42H51N6NiO13 [Isomères] |
| Masse molaire[1] | 906,580 1 ± 0,042 7 g/mol C 55,64 %, H 5,67 %, N 9,27 %, Ni 6,47 %, O 22,94 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Ce cofacteur doit son nom à son maximum d'absorption à λmax = 430 nm.
Structure
Le cofacteur F430 isolé est thermiquement instable et sensible à l'oxydation. Sa structure a été déterminée par cristallographie aux rayons X et spectroscopie RMN[2]. Il possède seulement cinq double liaisons, ce qui en fait le tétrapyrrole naturel le plus réduit.
La forme active du F430 contient le cation Ni(I), de façon analogue au cofacteur B12 qui contient le cation Co(I). Ces deux ions ont néanmoins une configuration électronique différente : Co(I) est diamagnétique avec une configuration en d8 tandis que Ni(I) est paramagnétique avec une configuration en d9. F430 est le seul tétrapyrrole biologique connu fonctionnant avec du nickel.
Il existe une variante du F430 thiométhylée sur le carbone 172, ce qui ne semble pas altérer les propriétés réactionnelles du cation Ni(I)[3].
Mécanisme proposé
Le mécanisme de clivage de la liaison CH3–S dans la méthyl-coenzyme M n'est pas complètement élucidé, bien qu'il soit établi que la coenzyme M et la coenzyme B s'insèrent sur la méthyl-coenzyme M réductase dans un canal terminé par le cofacteur F430, sur un site axial du nickel. Il est possible que Ni(I) transfère un électron au méthyle –CH3 pour former le méthane CH4 en laissant le nickel à l'état d'oxydation Ni(II) ; ce dernier est ensuite à nouveau réduit à l'état Ni(I) au moment du clivage de la liaison CH3–S de la méthyl-coenzyme M par la coenzyme B[4].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) G. Farber, W. Keller, C. Kratky, B. Jaun, A. Pfaltz, C. Spinner, A. Kobelt, A. Eschenmoser, « Coenzyme F430 from Methanogenic Bacteria: Complete Assignment of Configuration Based on an X-ray Analysis of 12,13-diepi-F430 Pentamethyl Ester and on NMR Spectroscopy », dans Helvetica Chimica Acta 1991, 74, 697-716.
- (en) S. Mayr et al., « Structure of an F430 variant from archaea associated with anaerobic oxidation of methane », dans J. Am. Chem. Soc. 2008, 130 (32), 10758–10767. DOI 10.1021/ja802929z
- (en) C. Finazzo, J. Harmer, C. Bauer, B. Jaun, E. C. Duin, F. Mahlert, M. Goenrich, R. K. Thauer, S. Van Doorslaer et A. Schweiger, « Coenzyme B Induced Coordination of Coenzyme M via Its Thiol Group to Ni(I) of F430 in Active Methyl-Coenzyme M Reductase », dans Journal of the American Chemical Society, 2003, 125, 4988-4989.