Chlorure de propanoyle
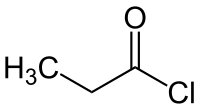
Le chlorure de propanoyle ou chlorure de propionyle et un composé organique de formule CH3CH2C(O)Cl. C'est le chlorure d'acyle dérivé de l'acide propanoïque.
| Chlorure de propanoyle | |
| |
| Identification | |
|---|---|
| Nom systématique | chlorure de propanoyle |
| Synonymes |
Chlorure de propionyle, chlorure propionique |
| No CAS | |
| No ECHA | 100.001.064 |
| PubChem | 62324 |
| SMILES | |
| InChI | |
| Apparence | liquide jaunâtre à l'odeur désagréable[1] |
| Propriétés chimiques | |
| Formule | C3H5ClO [Isomères] |
| Masse molaire[2] | 92,524 ± 0,005 g/mol C 38,94 %, H 5,45 %, Cl 38,32 %, O 17,29 %, |
| Propriétés physiques | |
| T° fusion | −94 °C[1] |
| T° ébullition | 80 °C[1] |
| Masse volumique | 1,06 g·cm-3 (20 °C)[1] |
| T° d'auto-inflammation | 270 °C[1] |
| Point d’éclair | 12 °C (coupelle fermée)[1] |
| Limites d’explosivité dans l’air | 3,6 - 11,9 vol.%[1] |
| Pression de vapeur saturante | 83 hPa (20 °C) 390 hPa (50 °C)[1] |
| Précautions | |
| SGH[1] | |
   |
|
| Transport[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés
Le chlorure de propanoyle se présente sous la forme liquide jaunâtre très volatil, à l'odeur désagréable. C'est un liquide hautement inflammable, dont les vapeurs forment avec l'air des mélanges explosifs. Il se décompose violemment dans l'eau, libérant du chlorure d'hydrogène. Il présente des risques aigus et chroniques pour la santé[1].
Synthèse
Le chlorure de propanoyle peut être obtenu en faisant réagir l'acide propanoïque avec du trichlorure de phosphore ou du chlorure de thionyle[3] - [4].
Utilisation
Le chlorure de propanoyle est utilisé comme réactif en synthèse organique. Il est notamment utilisé pour l'insertion du groupe propanoyle et la synthèse des esters propanoïques[5]. Dans les amides et esters dérivés chiraux, les atomes d'hydrogène du groupe méthylène sont diastéréotopes[6].
Notes et références
- Entrée « Propionyl chloride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 4 avril 2020 (JavaScript nécessaire).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Henry E. Roscoe, Carl Schorlemmer, Kurzes Lehrbuch der Chemie: nach den neuesten Ansichten der Wissenschaft, Vieweg, (lire en ligne), p. 188
- J.T. Gerig, Introductory Organic Chemistry, Elsevier, (ISBN 0-323-14091-2, lire en ligne), p. 279
- Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, (ISBN 3-527-30385-5, lire en ligne), p. 272
- James R. Gage et David A. Evans, « Diastereoselective Aldol Condensation Using a Chiral Oxazolidinone Auxiliary: (2S,3S)-3-Hydroxy-3-phenyl-2-methylpropanoic Acid », Org. Synth., vol. 68, , p. 83 (DOI 10.15227/orgsyn.068.0083)

