Chlorure d'ytterbium(II)
Le chlorure d'ytterbium(II) ou dichlorure d'ytterbium est un composé inorganique de formule YbCl2.
| Chlorure d'ytterbium(II) | |
| |
| __ Yb2+ __ Cl− | |
| Identification | |
|---|---|
| Nom UICPA | chlorure d'ytterbium(II) |
| Synonymes |
dichlorure d'ytterbium |
| No CAS | |
| No ECHA | 100.034.197 |
| No CE | 237-632-3 |
| PubChem | 83785 |
| SMILES | |
| InChI | |
| Apparence | solide incolore[1] ou vert[2] |
| Propriétés chimiques | |
| Formule | YbCl2 |
| Masse molaire[3] | 350,319 ± 0,015 g/mol Cl 50,6 %, Yb 49,4 %, |
| Propriétés physiques | |
| T° fusion | 720 °C[4] |
| T° ébullition | 1 300 °C[1] |
| Solubilité | réagit avec l'eau[2] soluble dans le THF[4] |
| Masse volumique | 5,27 g·cm-3[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés
Le chlorure d'ytterbium(II) se présente sous la forme d'un solide incolore[1] ou vert[2]. C'est un composé fortement hygroscopique qui ne peut être stocké ou manipulé que sous gaz protecteur ou bien à sec sous vide poussé. Dans l'air ou au contact de l'eau, il absorbe d'humidité et se transforme en hydrate, instable qui va se transformer plus ou moins rapidement en oxychlorure avec dégagement de dihydrogène.
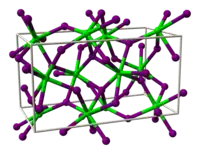
Le chlorure d'ytterbium(II) a une structure cristalline identique à celle de l'iodure de strontium[1] - [5]. Klemm et Schüth ont décrit le composé comme un solide presque incolore, diamagnétique, qui se dissout dans l'eau avec la couleur jaune, et beaucoup plus stable que le chlorure de samarium(II) ou que le chlorure d'europium(II) dont il est proche. Le composé réagit avec l'ammoniaque et prend une teinte rouge.
Synthèse
Le chlorure d'ytterbium(II) a été préparé la première fois en 1929 par W. K. Klemm et W. Schüth, par réduction du chlorure d'ytterbium(III) (YbCl3) par le dihydrogène[6] - [7]. Cette méthode, toujours employée, nécessite de hautes températures (entre 500 °C et 600 °C)[1] :
- 2YbCl3+ H2 → 2YbCl2+ 2HCl
Une réaction similaire peut être obtenue avec le zinc dans le chlorure de zinc à 500 °C[1].
Il est également possible de synthtiser YbCl2 par réduction d'YbCl3 par le lithium en présence de naphtalène[8] :
- YbCl3 + Li → YbCl2 + LiCl
Notes et références
- (de) Georg Brauer, Handbuch der präparativen anorganischen Chemie, vol. III, Enke, Stuttgart, , 3e éd., 2113 p. (ISBN 3-432-87823-0), p. 1444
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, CRC Press, , 93e éd. (ISBN 978-1-4398-8049-4 et 1-4398-8049-2, lire en ligne), p. 4-99
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David Crich, Handbook of Reagents for Organic Synthesis, Reagents for Radical and Radical Ion Chemistry, John Wiley & Sons, , 728 p. (ISBN 978-1-118-63487-5, lire en ligne), p. 651
- (de) H. Bärnighausen, H. Pätow et H. P. Beck, « Kristallchemische Studien an Seltenerd-Dihalogeniden. Die Kristallstruktur von Ytterbium(II)-chlorid, YbCl2. », Zeitschrift für anorganische und allgemeine Chemie, no 403, , p. 45–55 (DOI 10.1002/zaac.19744030106)
- (en) H.J. Emeléus et A.G. Sharpe, Advances in inorganic chemistry and radiochemistry, Academic Press, (ISBN 0-08-057869-1, lire en ligne), p. 651
- (de) Wilhelm Klemm et Wilhelm Schüth, « Messungen an zwei- und vierwertigen Verbindungen der seltenen Erden. III. Ytterbiumdichlorid. », Zeitschrift für anorganische und allgemeine Chemie, no 184, , p. 352–358 (DOI 10.1002/zaac.19291840128)
- (de) Kurt Rossmanith, « Messungen an zwei- und vierwertigen Verbindungen der seltenen Erden. III. Ytterbiumdichlorid. », Monatshefte für Chemie, no 110, , p. 109–114 (DOI 10.1007/BF00903752)
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Ytterbium(II) chloride » (voir la liste des auteurs) et en allemand « Ytterbium(II)-chlorid » (voir la liste des auteurs).