Chimie click
Dans le domaine de la synthèse chimique, la chimie clic, ou chimie click (click chemistry en anglais ou plus communément tagging) est une classe de réactions chimiques biocompatibles utilisées pour joindre à un substrat choisi une biomolécule spécifique (le click peut évoquer le bruit imaginaire d'un clipsage d'une molécule sur l'autre).
La notion de chimie clic ne décrit pas simplement l'utilisation de réactions spécifiques (réactions de couplage ou plus complexes telles que des réactions de cycloaddition par clic), mais aussi une façon de générer des « produits » en s'inspirant des exemples de la nature (elle s'inscrit pour partie dans le biomimétisme), pour par exemple générer des biopolymères (ou d'autres molécules d'intérêt biochimique) en regroupant de petites unités modulaires (en quelque sorte clipsables entre elles)[1].
Contextes d'utilisation
La chimie clic concerne souvent le vivant et la chimie verte, mais n'est pas strictement limitée au contexte biologique : le concept d'une réaction en « clic » a aussi été utilisé pour des applications pharmacologiques, de marquage (ex. : le marquage de protéines au carbone 11 et au fluor 18[2]) et diverses applications biomimétiques. Cependant cette méthode s'est montrée notablement utile dans la détection, la localisation et la qualification de biomolécules. Elle peut contribuer à la production de cristaux liquides[3].
La nanomédecine, les nanomatériaux et les nanotechnologies sont d'autres domaines d'utilisation[4] - [5].
Éléments de définition
Le plus souvent, la chimie clic fait se joindre une biomolécule d'intérêt (protéine) et une autre molécule (dite « reporter »).
Elles fonctionnent métaphoriquement comme un clipsage « à ressort » — caractérisées par une forte force motrice thermodynamique qui conduit rapidement et de façon irréversible à un rendement élevé d'un seul produit de réaction, avec une forte spécificité (parfois avec les deux régio- et stéréospécificité).
Selon Sharpless, une « réaction clic » souhaitable doit être[6] :
- modulaire ;
- à l'échelle ;
- à hauts rendements chimiques ;
- propre (ne générer que des sous-produits inoffensifs) ;
- stéréospécifique ;
- physiologiquement stable ;
- dotée d'une grande force motrice thermodynamique (> 84 kJ/mol) à la faveur d'une réaction avec un seul produit de réaction (une réaction nettement exothermique fait un réactif « à ressort ») ;
- économe en atomes (cf. « atom economy »).
Le processus devrait idéalement :
- nécessiter des conditions de réaction simples ;
- ne nécessiter que des matériaux et réactifs facilement disponibles ;
- ne pas nécessiter de solvant ou alors un solvant bénin (de préférence de l'eau) ;
- fournir des produits faciles à détecter ou isoler par des méthodes non-chromatographiques (cristallisation ou distillation).
Plusieurs de ces critères sont subjectifs, et même si des critères mesurables et objectifs sont susceptibles d'être acceptés, il est peu probable que la réaction sera parfaite pour chaque situation et chaque application. Mais plusieurs types de réactions ont été identifiés qui semblent mieux répondre à ces critères que d'autres :
- cycloadditions [3+2] comme la cycloaddition 1,3-dipolaire de Huisgen, en particulier catalysée par le Cu(I) et par étapes variantes[7] ;
- réaction thiol-ène[8] - [9] ;
- réaction de Diels-Alder et réaction de Diels-Alder à demande d'électrons inverse (en)[10] ;
- cycloadditions [4+1] entre les isonitriles (isocyanides) et tétrazines[11] ;
- substitution nucléophile (en particulier pour de petits composés d'époxyde[12] et aziridine) ;
- des réactions de chimie-carbonyl comme la formation des urées, mais pas les réactions de type aldol en raison de leur faible force thermodynamique motrice ;
- des réactions d'addition à liaison double carbone-carbone comme la dihydroxylation ou les alcynes dans la réaction thiol-yne (en).
Intérêt, spécificités
Les réactions clic se produisent en synthèse monotope. Elles ne sont pas gênées par l'eau. Elles ne génèrent que très peu de sous-produits (qui sont par ailleurs inoffensifs).
Ces qualités rendent ces réactions particulièrement adaptées aux besoins d'isolement et de ciblage de molécules complexes dans les milieux biologiques où les réactions doivent être physiologiquement stables et biocompatibles (tous les sous-produits doivent être non toxiques (in vivo et pas seulement in vitro). Elles sont également adaptées à la vectorisation de principes actifs (médicaments) vers une molécule précise dans l'organisme ou vers un type précis de cellules.
En développant des réactions bioorthogonales spécifiques et contrôlables, les scientifiques ont aussi ouvert la possibilité de cibler des objectifs particuliers dans les lysats cellulaires complexes. Récemment, on a ainsi pu adapter des réactions clic au milieu interne de cellules vivantes, dont à l'aide de très petites molécules-sondes (Affimer, qui sont des sortes d'anticorps artificiels). Ces molécules peuvent trouver leurs cibles et s'y fixer (clic). Malgré les défis posés par la perméabilité de la cellule et les réactions du système immunitaire, les réactions clic ont déjà prouvé leur utilité dans une nouvelle génération d'expériences d'immunoprécipitation et en spectrométrie de fluorescence (où un fluorophore est attaché à une cible d'intérêt qui peut alors être quantifiée et/ou localisée).
Plus récemment, d'autres méthodes nouvelles ont été utilisées pour incorporer des éléments « chimio-cliquables » sur et dans des biomolécules, y compris pour l'incorporation d'acides aminés non naturels contenant des groupes protéiques réactifs en protéines et des nucléotides modifiés. Ces techniques représentent une partie du domaine de la biologie chimique, et de la biologie synthétique où la chimie clic joue un rôle fondamental en permettant des couplages plus intentionnels et précis d'unités modulaires, à des fins diverses.
Histoire
Le terme de click chemistry a été inventé par K. Barry Sharpless, chimiste de l'Institut de recherche Scripps en 1998.
Il n'a été décrit par Sharpless, avec Hartmuth Kolb et M.G Finn, qu'en 2001, comme une méthode chimique permettant de générer « sur mesure » des substances par couplage de petites unités de manière rapide, efficace et reproductible[6] - [13].
Arrière-plan
La chimie clic est une méthode de fixation d'une sonde ou d'un élément d'intérêt à une biomolécule, via un processus (le clic) qui est une conjugaison biochimique (ou « bioconjugaison »).
La possibilité offerte d'attacher des fluorophores et d'autres « molécules reporters » a fait de la chimie clic un outil puissant pour l'identification, la localisation et la caractérisation à la fois d'anciennes et de nouvelles biomolécules.
Comme avec les autres méthodes, l'insertion d'une molécule (fluorophore par exemple), même de petite taille dans une protéine d'intérêt, peut affecter ses fonctions et son expression (car elle affecte la forme de la protéine et éventuellement son repliement, surtout si la fixation se fait sur une partie fonctionnellement importante de la protéine cible).
Pour surmonter ou contourner ces défis, les chimistes ont choisi de procéder en identifiant préalablement des paires de molécules « partenaires » pouvant interagir selon des réactions bioorthogonales. Ceci leur permet d'utiliser des molécues exogènes très petites comme sondes biomoléculaires. Un fluorophore peut être rattaché à l'une de ces sondes pour donner un signal de fluorescence lors de la liaison de la molécule rapporteur de la cible.
Exemple : cycloaddition azoture-alcyne catalysée par le cuivre(I) (CuAAC)
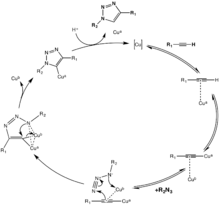
Une réaction clic classique[14] - [15] est la réaction catalysée par le cuivre(I) d'un azoture avec un alcyne, qui fournit un triazole 1,4 disubstitué. De telles réactions (cycloadditions) ont été signalées par Arthur Michael dès 1893[16]. Plus tard, vers le milieu du XXe siècle, cette famille de cycloadditions 1,3-dipolaire a pris le nom d'« Huisgen » après des études de leur cinétique et conditions de réactions.
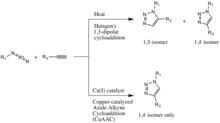
La catalyse de la cycloaddition de Huisgen 1,3 dipolaire par des sels de cuivre(I) a été découverte simultanément et indépendamment par les groupes de Valery V. Fokine et K. Barry Sharpless à l'Institut de recherche Scripps en Californie[17] et Morten Meldal dans le Laboratoire de Carlsberg, Danemark[18]. La version catalysée de cette réaction ne donne que de l'isomère 1,4 du triazole résultant, tandis que la réaction de Huisgen classique offre à la fois les isomères 1,4 et 1,5, est lente et nécessite une température de 100 °C[16].
Notes et références
- Bernard J., Drockenmuller E., Fleury E., Pascault J.P., Fontaine L. et Daniel J.C. (2010), « « La chimie click » : Quelles perspectives pour les polymères ? », L'Actualité chimique, 344, 51-56.
- T. Bordenave, Apport de la chimie ‘‘click’’pour le marquage au carbone-11 et au fluor-18 de nucléosides et d’oligonucléotides, thèse, Bordeaux-1, 2012 (résumé).
- Guerra S. (2012), La chimie click au service des cristaux liquides, thèse, Université de Neuchâtel.
- Ripert M. (2013), Développement d'une stratégie d'adressage sur or par chimie « click » électro-catalysée : application à la détection sans marquage de biomolécules, thèse, université Claude-Bernard Lyon-I.
- (en) I. Nierengarten et J.-F. Nierengarten, The impact of the copper-catalyzed alkyne-azide 1,3-dipolar cycloaddition in fullerene chemistry, vol. 15, Chem. Rec., (présentation en ligne), p. 31-51.
- H. C. Kolb, M. G. Finn et K. B. Sharpless, « Click Chemistry: Diverse Chemical Function from a Few Good Reactions », Angewandte Chemie International Edition, vol. 40, no 11, , p. 2004–2021 (PMID 11433435, DOI 10.1002/1521-3773(20010601)40:11<2004::AID-ANIE2004>3.0.CO;2-5).
- Spiteri, Christian et Moses, John E., « Copper-Catalyzed Azide–Alkyne Cycloaddition: Regioselective Synthesis of 1,4,5-Trisubstituted 1,2,3-Triazoles », Angewandte Chemie International Edition, vol. 49, no 1, , p. 31–33 (DOI 10.1002/anie.200905322).
- Hoyle, Charles E. et Bowman, Christopher N., « Thiol–Ene Click Chemistry », Angewandte Chemie International Edition, vol. 49, no 9, , p. 1540–1573 (DOI 10.1002/anie.200903924).
- Lowe, A. B., Polymer Chemistry, 2010, 1 (1), 17–36.
- Blackman, Melissa L. et Royzen, Maksim et Fox, Joseph M., « Tetrazine Ligation: Fast Bioconjugation Based on Inverse-Electron-Demand Diels−Alder Reactivity », Journal of the American Chemical Society, vol. 130, no 41, , p. 13518–13519 (PMID 18798613, PMCID 2653060, DOI 10.1021/ja8053805).
- Stöckmann, Henning, Neves, Andre, Stairs, Shaun, Brindle, Kevin et Leeper, Finian, « Exploring isonitrile-based click chemistry for ligation with biomolecules », Organic & Biomolecular Chemistry, vol. 9, , p. 7303 (DOI 10.1039/C1OB06424J).
- Kashemirov, Boris A., Bala, Joy L. F., Chen, Xiaolan, Ebetino, F. H., Xia, Zhidao, Russell, R. Graham G., Coxon, Fraser P., Roelofs, Anke J., Rogers Michael J. et McKenna, Charles E., « Fluorescently labeled risedronate and related analogues: « magic linker » synthesis », Bioconjugate Chemistry, vol. 19, , p. 2308–2310 (DOI 10.1021/bc800369c).
- R. A. Evans, « The Rise of Azide–Alkyne 1,3-Dipolar 'Click' Cycloaddition and its Application to Polymer Science and Surface Modification », Australian Journal of Chemistry, vol. 60, no 6, , p. 384–395 (DOI 10.1071/CH06457).
- Development and Applications of Click Chemistry, Gregory C. Patton, 8 novembre 2004, sur chemistry.uiuc.edu.
- H.C. Kolb et Sharpless, B.K., « The growing impact of click chemistry on drug discovery », Drug Discov Today, vol. 8, no 24, , p. 1128–1137 (PMID 14678739, DOI 10.1016/S1359-6446(03)02933-7).
- L. Liang et D. Astruc, The copper(I)-catalysed alkyne-azide cycloaddition (CuAAC) « click » reaction and its applications.
- Vsevolod V. Rostovtsev, Green, Luke G, Fokin, Valery V. et Sharpless, K. Barry, « A Stepwise Huisgen Cycloaddition Process: Copper(I)-Catalyzed Regioselective « Ligation » of Azides and Terminal Alkynes », Angewandte Chemie International Edition, vol. 41, no 14, , p. 2596–2599 (DOI 10.1002/1521-3773(20020715)41:14<2596::aid-anie2596>3.0.co;2-4).
- Tornoe, C. W., Christensen, C. et Meldal, M., « Peptidotriazoles on Solid Phase: [1,2,3]-Triazoles by Regiospecific Copper(I)-Catalyzed 1,3-Dipolar Cycloadditions of Terminal Alkynes to Azides », Journal of Organic Chemistry, vol. 67, no 9, , p. 3057–3064 (PMID 11975567, DOI 10.1021/jo011148j).
Voir aussi
Articles connexes
Bibliographie
- Adam de Beaumais S. (2012), Apport de la chimie click à la diversité des applications de cyclodextrines fonctionnalisées, thèse, Paris-6 (résumé).
- De Los Cobos, O., Lejeune, M., Colas-Dutreilh, M., Rossignol, F., Carrion, C., Boissiere, C., … et Durand, J. O. (avril 2012), Réseaux multifonctionnels élaborés par impression jet d'encre et chimie « click » pour des applications de type biocapteurs, dans Journées Annuelles du Groupe Français de la Céramique (GFC).
- El Haitami, A. E., Thomann, J. S., Jierry, L., Parat, A., Voegel, J. C., Schaaf, P., … etc. et Frisch, B. (2010), Chapitre 4 Construction de films multicouches composés de poly (acide acrylique) et d’oligomères d’éthylène glycol par chimie « click », université de Strasbourg, 4.
- Gautier A. (2010), Utilisation de ligands en chimie click. Applications à des cibles d'intérêts biologiques. Dans Centre de biophysique moléculaire–UPR 4301, mai 2010.
- Lafarge J. (2012), Greffage de copolymeres antibactériens sur des surfaces PVC par chimie Click, thèse, INSA de Rouen.
- Li C. (2010), Synthèse de nouveaux acides aminés et stéroides par la click chimie, thèse, Cachan, École normale supérieure, en cotutelle avec Shanghai, East China Normal University (lien).
- Mahouche S. (2009), Matériaux polymères chélatants pour la complexation d'ions et de nanoparticules métalliques : [combinaisons] de sels de diazonium avec l'ATRP et la chimie click, thèse, Paris-7, résumé.
- Mischler S. (2012), La chimie click pour la conception de nanoparticules d'or liquides-cristallines, thèse, Université de Neuchâtel.
- Moitra N. (2011), Silices hybrides fonctionnelles: matériaux dérivés d'alcaloïdes pour organocatalyse ; réactions « click » pour le sol˗gel, thèse, École nationale supérieure de chimie (lien).
- Thevenet D. (2010), Synthèse de dimères de triphénylènes basée sur la chimie click, thèse, Université de Neuchâtel, 230 p..
- Petrelli A. (2015), Synthèse de glycoconjugués macromoléculaires par chimie click non metallo-catalysée pour des applications médicales], sous la dir. de Sébastien Fort, à Grenoble Alpes / Chimie et Sciences du Vivant, en partenariat avec CERMAV - CEntre de Recherche sur les MAcromolécules Végétales (laboratoire) et de Glycochimie et biotechnologie des oligosaccharides (équipe de recherche) à partir du 28 novembre 2012, résumé.
- Ripert M. (2013), Développement d'une stratégie d'adressage sur or par chimie « click » électro-catalysée: application à la détection sans marquage de biomolécules, thèse, université Claude-Bernard-Lyon-I.
- Toulemon D. (2013), d'assemblage par chimie « click » de nanoparticules magnétiques sur des surfaces fonctionnalisées, thèse, université de Strasbourg.