Centre respiratoire
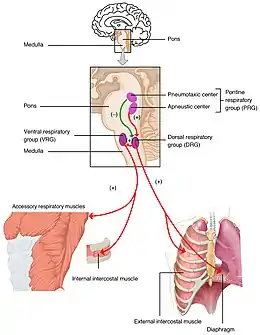
Le centre respiratoire correspond à des centres de contrôle dans le système nerveux qui gèrent la ventilation pulmonaire. Chez l'humain, il est situé dans la moelle allongée et le pont, dans le tronc cérébral. Le centre respiratoire est composé de trois grands groupes de neurones respiratoires, deux dans la moelle allongée — le groupe respiratoire dorsal et le groupe respiratoire ventral — et un dans le pont. Le groupe respiratoire pontique comprend deux zones appelées centre pneumotaxique et centre apneustique.
| MeSH |
D012125 |
|---|
Le centre respiratoire est chargé de générer et de maintenir le rythme de la respiration, mais aussi de l'ajuster pour maintenir une réponse homéostatique aux changements physiologiques. Le centre respiratoire reçoit l'apport des chimiorécepteurs, des mécanorécepteurs, du cortex cérébral et de l'hypothalamus afin de réguler le rythme et la profondeur de la respiration. Le centre est stimulé par des niveaux altérés d'oxygène, de dioxyde de carbone ou du pH sanguin, par des changements hormonaux liés au stress et à l'anxiété provenant de l'hypothalamus, ainsi que par des signaux du cortex cérébral permettant un contrôle conscient de la respiration.
Des lésions des différents groupes respiratoires peuvent altérer les fonctions respiratoires, ce qui peut nécessiter une ventilation mécanique. Elles sont généralement d'un mauvais pronostic.
Groupes respiratoires
Le centre respiratoire est divisé en trois groupes principaux, deux dans la moelle allongée et un dans le pont. Les deux groupes de la moelle allongée sont le groupe respiratoire dorsal et le groupe respiratoire ventral. Le groupe respiratoire pontique, quant à lui, est composé de deux zones : le centre pneumotaxique et le centre apneustique. Les groupes médullaires dorsal et ventral contrôlent le rythme de base de la respiration[1] - [2]. Les groupes sont apairés avec un de chaque côté du tronc cérébral[3].
Groupe respiratoire dorsal
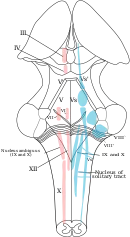
Le groupe respiratoire dorsal (GRD) a le rôle le plus fondamental dans le contrôle de la respiration, initiant l'inspiration (inhalation). Le GRD est une collection de neurones formant une structure allongée s'étendant sur la majeure partie de la longueur de la moelle dorsale. Ils sont proches du canal central de la moelle spinale et juste derrière le groupe ventral. Ils fixent et maintiennent le rythme respiratoire[4] - [5].
La plupart des neurones sont situés dans le noyau du faisceau solitaire. D'autres neurones importants se trouvent dans les zones adjacentes, y compris la substance réticulaire de la moelle. Le noyau solitaire est le point terminal pour les informations sensorielles provenant du groupe respiratoire pontique et de deux nerfs crâniens : le nerf vague et le nerf glossopharyngien. Le noyau solitaire envoie des signaux au centre respiratoire à partir de chimiorécepteurs périphériques, de barorécepteurs et d'autres types de récepteurs situés dans les poumons, en particulier les récepteurs d'étirement. Le groupe respiratoire dorsal est ainsi considéré comme un centre intégrateur qui délivre un signal au groupe respiratoire ventral pour modifier le rythme respiratoire[4] - [5].
Groupe respiratoire ventral
Le groupe respiratoire ventral (GRV) se compose de quatre groupes de neurones qui commandent l'expiration. Cette zone se trouve dans la partie ventrolatérale de la moelle allongée, à environ 5 mm en avant et sur le côté du groupe respiratoire dorsal. Les neurones impliqués comprennent ceux du noyau ambigu (groupe respiratoire parafacial), du noyau rétroambigu (noyau rétro-trapézoïde) et les interneurones du complexe pré-Bötzinger (en)[6].
Le GRV contient à la fois des neurones inspiratoires et expiratoires[7] - [4]. Le groupe des neurones respiratoires ventraux est actif lors de la respiration forcée et inactif pendant les respirations calmes et reposantes[1]. Le GRV envoie des impulsions inhibitrices au centre apneustique.
Groupe respiratoire pontin
Dans le tegmentum pontin des pons, le groupe respiratoire pontin (GRP) comprend les centres pneumotaxiques et apneustiques. Ceux-ci sont connectés entre eux et chacun au noyau solitaire[8].
Centre pneumotaxique
Le centre pneumotaxique est situé dans la partie supérieure du pont. Ses noyaux sont le noyau sous-parabrachial et le noyau parabrachial médial[9]. Le centre pneumotaxique contrôle à la fois le rythme et la profondeur de la respiration. Le centre pneumotaxique est considéré comme un antagoniste du centre apneustique (qui produit une respiration anormale pendant l'inhalation) inhibant cycliquement l'inhalation. Le centre pneumotaxique est responsable de la limitation de l'inspiration, fournissant un interrupteur inspiratoire (IOS)[10]. Il limite l'éclatement des potentiels d'action dans le nerf phrénique, diminuant efficacement le volume courant et régulant la fréquence respiratoire. L'absence du centre entraine une augmentation de la profondeur de la respiration et une diminution de la fréquence respiratoire.
Le centre pneumotaxique régule la quantité d'air qui peut être absorbée par le corps à chaque respiration. Le groupe respiratoire dorsal a des sursauts rythmiques d'activité dont la durée et l'intervalle sont constants[11]. Lorsqu'un rythme respiratoire plus rapide est nécessaire, le centre pneumotaxique signale au groupe respiratoire dorsal d'accélérer. Lorsque des respirations plus longues sont nécessaires, les sursauts d'activité sont allongés. Toutes les informations que le corps utilise pour aider à la respiration se produisent dans le centre pneumotaxique. Si cela était endommagé ou blessé, cela rendrait la respiration presque impossible.
Une étude sur ce sujet portait sur des chats paralysés anesthésiés avant et après une vagotomie bilatérale. La ventilation a été surveillée chez les chats éveillés et anesthésiés respirant de l'air ou du CO2. La ventilation a été surveillée avant et après les lésions de la région centrale pneumotaxique et après une vagotomie bilatérale ultérieure. Les chats présentant des lésions pontiques avaient une durée d'inhalation prolongée[12]. Chez le chat, après anesthésie et bivagotomie, la transection pontale a été décrite comme évoquant une décharge inspiratoire longue et prolongée interrompue par de courtes pauses expiratoires. En revanche, chez le rat, après anesthésie, bivagotomie et transection pontale, ce schéma respiratoire n'a pas été observé , in vivo ou in vitro. Ces résultats suggèrent des différences interspécifiques entre le rat et le chat dans les influences pontines sur le centre respiratoire médullaire[13].
Centre apneustique
Le centre apneustique des pons inférieurs semble favoriser l'inhalation par une stimulation constante des neurones de la moelle oblongue. Le centre apneustique envoie des signaux au groupe dorsal de la médullaire pour retarder la «coupure», le signal de coupure inspiratoire (IOS) de la rampe inspiratoire fourni par le centre pneumotaxique. Il contrôle l'intensité de la respiration, donnant des impulsions positives aux neurones impliqués dans l'inhalation. Le centre apneustique est inhibé par les récepteurs pulmonaires d'étirement et également par le centre pneumotaxique. Il décharge également une impulsion inhibitrice au centre pneumotaxique.
Rythme respiratoire
La respiration est le processus répétitif d'amener de l'air dans les poumons et d'évacuer les déchets. Le dioxygène apporté par l'air est un besoin constant pour maintenir un organisme en vie. Ce besoin reste présent pendant le sommeil, de sorte que le fonctionnement de ce processus doit être automatique et faire partie du système nerveux autonome. L'inspiration est suivie de l'expiration, donnant le cycle respiratoire de l'inspiration et de l'expiration. Il y a trois phases du cycle respiratoire : l'inspiration, l'expiration post-inspiration ou passive, et l'expiration tardive ou active[14] - [15].
La fréquence respiratoire, à savoir le nombre de cycles par minute, est définie dans le centre respiratoire par le groupe respiratoire dorsal. Ces neurones sont principalement concentrés dans le noyau solitaire qui s'étend sur la longueur de la moelle allongée[4].
Le rythme de base de la respiration est celui d'une respiration calme et reposante appelée eupnée. Une respiration calme ne nécessite que l'activité du groupe dorsal qui active le diaphragme et les muscles intercostaux externes. L'expiration est passive et repose sur le recul élastique des poumons. Lorsque le besoin métabolique en oxygène augmente, l'inspiration devient plus puissante et les neurones du groupe ventral sont activés pour provoquer une expiration forcée[1]. L'essoufflement est appelé dyspnée par opposition à l'eupnée.
Signification clinique
La dépression du centre respiratoire peut être causée par un traumatisme crânien, des lésions cérébrales, une tumeur cérébrale ou une ischémie. Une dépression peut également être causée par des médicaments, notamment des opioïdes et des sédatifs.
Le centre respiratoire peut être stimulé par l'amphétamine, permettant d'obtenir des respirations plus rapides et plus profondes[16]. Normalement, aux doses thérapeutiques, cet effet n'est pas perceptible, mais il peut être mis en évidence lorsque la respiration est compromise[16].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Respiratory center » (voir la liste des auteurs).
- G Tortora et B Derrickson, Principles of anatomy & physiology., Wiley, 13th. éd., 906–909 p. (ISBN 978-0-470-64608-3)
- Gillian Pocock et Christopher D. Richards, Human physiology : the basis of medicine, Oxford, Oxford University Press, , 3e éd., 656 p. (ISBN 978-0-19-856878-0), p. 332
- Kenneth Saladin, Anatomy & Physiology : The Unity of Form and Function, , 868-871 p. (ISBN 978-0-07-337825-1)
- John Hall, Guyton and Hall textbook of medical physiology, Philadelphia, Pa., Saunders/Elsevier, , 12e éd., 505–510 p. (ISBN 978-1-4160-4574-8)
- K Saladin, Human anatomy, McGraw-Hill, , 3e éd., 646–647 p. (ISBN 978-0-07-122207-5)
- Claude Martin, Benoît Vallet et Bruno Riou, Physiologie humaine appliquée, Arnette, , p. 23
- (en) Bruce M. Koeppen et Bruce A. Stanton, Berne and Levy Physiology E-Book, Elsevier Health Sciences, , 944 p. (ISBN 978-0-323-52340-0, lire en ligne)
- G Song et CS Poon, « Functional and structural models of pontine modulation of mechanoreceptor and chemoreceptor reflexes. », Respiratory Physiology & Neurobiology, vol. 143, nos 2–3, , p. 281–92 (PMID 15519561, DOI 10.1016/j.resp.2004.05.009)
- Gang Song, Yunguo Yu et Chi-Sang Poon, « Cytoarchitecture of Pneumotaxic Integration of Respiratory and Nonrespiratory Information in the Rat », Journal of Neuroscience, vol. 26, no 1, , p. 300–10 (PMID 16399700, DOI 10.1523/JNEUROSCI.3029-05.2006)
- M Dutschmann et TE Dick, « Pontine mechanisms of respiratory control. », Comprehensive Physiology, vol. 2, no 4, , p. 2443–69 (PMID 23720253, PMCID 4422496, DOI 10.1002/cphy.c100015)
- Mathias Dutschmann, Comprehensive Physiology., Bethesda, Md., John Wiley and Sons, (ISBN 978-0-470-65071-4)
- H Gautier et F Bertrand, « Respiratory effects of pneumotaxic center lesions and subsequent vagotomy in chronic cats », Respiration Physiology, vol. 23, no 1, , p. 71–85 (PMID 1129551, DOI 10.1016/0034-5687(75)90073-0)
- R. Monteau, S. Errchidi, P. Gauthier, G. Hilaire et P. Rega, « Pneumotaxic centre and apneustic breathing: Interspecies differences between rat and cat », Neuroscience Letters, vol. 99, no 3, , p. 311–6 (PMID 2725956, DOI 10.1016/0304-3940(89)90465-5)
- M Mörschel et M Dutschmann, « Pontine respiratory activity involved in inspiratory/expiratory phase transition. », Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, vol. 364, no 1529, , p. 2517–26 (PMID 19651653, PMCID 2865127, DOI 10.1098/rstb.2009.0074)
- JM Ramirez, T Dashevskiy, IA Marlin et N Baertsch, « Microcircuits in respiratory rhythm generation: commonalities with other rhythm generating networks and evolutionary perspectives. », Current Opinion in Neurobiology, vol. 41, , p. 53–61 (PMID 27589601, PMCID 5495096, DOI 10.1016/j.conb.2016.08.003)
- (en) Westfall DP, Westfall TC, Goodman & Gilman's Pharmacological Basis of Therapeutics, New York, USA, McGraw-Hill, , 12e éd., 2084 p. (ISBN 978-0-07-162442-8, lire en ligne), « Miscellaneous Sympathomimetic Agonists »
Voir aussi
Liens internes
Bibliographie
Liens externes
- Roger Shannon, David M. Baekey, Kendall F. Morris, Sarah C. Nuding, Lauren S. Segers et Bruce G. Lindsey, « Pontine respiratory group neuron discharge is altered during fictive cough in the decerebrate cat », Respiratory Physiology & Neurobiology, vol. 142, no 1, , p. 43–54 (PMID 15351303, DOI 10.1016/j.resp.2004.05.002)