Cellule neuroépithéliale
Les cellules neuroépithéliales, ou cellules neuroectodermiques, sont les cellules formant la paroi du tube neural fermé au début du développement embryonnaire. Les cellules neuroépithéliales s'étendent sur l'épaisseur de la paroi du tube, se connectant à la surface piale et à la surface ventriculaire ou luminale. Ils sont reliés à la lumière du tube par des complexes jonctionnels, où ils forment une couche d' épithélium pseudostratifiée appelée neuroépithélium[1].
Les cellules neuroépithéliales sont les cellules souches neurales du système nerveux central. Elle génèrent des cellules progénitrices intermédiaires appelées cellules gliales radiales, qui se différencient à leur tour en neurones et en cellules gliales au cours de la neurogenèse[1] .
Développement neuronal embryonnaire
Le développement du cerveau
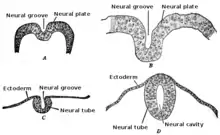
Au cours de la troisième semaine de croissance embryonnaire, le cerveau commence à se développer chez le fœtus précoce au cours d'un processus appelé morphogenèse[2]. Les cellules neuroépithéliales de l'ectoderme commencent à se multiplier rapidement et se replient en formant la plaque neurale, qui s'invagine au cours de la quatrième semaine de croissance embryonnaire et forme le tube neural[2] . La formation du tube neural polarise les cellules neuroépithéliales en orientant le côté apical de la cellule vers l'intérieur, qui devient plus tard la zone ventriculaire, et le côté basal est orienté vers l'extérieur, qui entre en contact avec la pie-mère ou la surface externe du cerveau en développement[3]. Dans le cadre de cette polarité, les cellules neuroépithéliales expriment la prominine-1 dans la membrane plasmique apicale ainsi que des jonctions serrées pour maintenir la polarité cellulaire[4]. L'intégrine alpha 6 ancre les cellules neuroépithéliales à la lame basale[4] . Le tube neural commence par une seule couche de cellules épithéliales pseudostratifiées, mais la prolifération rapide des cellules neuroépithéliales crée des couches supplémentaires et finalement trois régions distinctes de croissance[2] - [4]. Comme ces couches supplémentaires forment la polarité apicale-basale doit être régulée à la baisse[3]. Une prolifération supplémentaire des cellules dans ces régions donne naissance à trois zones distinctes du cerveau : le cerveau antérieur, le mésencéphale et le cerveau postérieur . Le tube neural donne également naissance à la moelle épinière[2] .
Prolifération des cellules neuroépithéliales
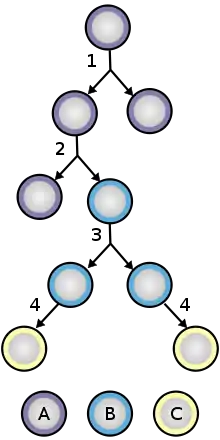
Les cellules neuroépithéliales sont une classe de cellules souches et ont la capacité de s'auto-renouveler. Lors de la formation du tube neural, les cellules neuroépithéliales subissent des divisions prolifératives symétriques qui donnent naissance à deux nouvelles cellules neuroépithéliales. À un stade ultérieur du développement du cerveau, les cellules neuroépithéliales commencent à s'auto-renouveler et donnent naissance à des progéniteurs non-souches, tels que les cellules gliales radiales simultanément en subissant une division asymétrique. L'expression de Tis21, un gène antiprolifératif, fait passer la cellule neuroépithéliale de la division proliférative à la division neuronique. De nombreuses cellules neuroépithéliales se divisent également en cellules gliales radiales, une cellule similaire, mais dont le destin est plus restreint. Étant une cellule dont le destin est plus restreint, la cellule gliale radiale générera soit des neurones postmitotiques, des cellules progénitrices intermédiaires ou des astrocytes dans la gliogenèse . Au cours de la division cellulaire neuroépithéliale, la migration nucléaire intercinétique permet aux cellules de se diviser sans restriction tout en maintenant un emballage dense. Au cours de G1, le noyau cellulaire migre vers le côté basal de la cellule et y reste pour la phase S et migre vers le côté apical pour la phase G2 . Cette migration nécessite l'aide de microtubules et de filaments d'actine[4] .
Transition radiale des cellules gliales
Les cellules neuroépithéliales donnent naissance à des cellules progénitrices gliales radiales au début du développement embryonnaire. Pour effectuer ce changement, les cellules neuroépithéliales commencent à réguler à la baisse leurs caractéristiques épithéliales, en arrêtant l'expression de l' occludine, une protéine de jonction serrée[3]. La perte d'occludine entraîne une perte des anciens joints de jonction serrée qui sont nécessaires à la génération de neuroblastes . Une autre protéine de jonction serrée , PARD3, reste du côté apical de la cellule en co-localisation avec la N-cadhérine et maintient intacte la face apicale de la cellule neuroépithéliale[4]. En l'absence d'occludine, une certaine polarité est toujours perdue et la cellule neuroépithéliale donne naissance à la cellule gliale radiale[4].
Neurogenèse adulte
Genèse des cellules neuroépithéliales dans le SNC adulte
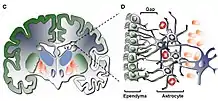
Dans le SNC adulte, les cellules neuroépithéliales apparaissent dans plusieurs zones différentes du cerveau : la zone sous-ventriculaire (SVZ), le bulbe olfactif et le gyrus denté de l' hippocampe . Ces cellules n'apparaissent dans aucun système nerveux périphérique . Souvent classées dans la catégorie des cellules souches neurales, les cellules neuroépithéliales ne donnent naissance qu'à quelques variétés de cellules neurales, ce qui les rend multipotentes - une nette distinction avec les cellules souches pluripotentes trouvées dans le développement embryonnaire. Les cellules neuroépithéliales subissent une mitose générant davantage de cellules neuroépithéliales, de cellules gliales radiales ou de cellules progénitrices, ces deux dernières se différenciant en neurones ou en cellules gliales. Les cellules neuroépithéliales subissent deux formes différentes de mitose : une division différenciée asymétrique et une division prolifique symétrique[4]. La division cellulaire asymétrique donne lieu à deux variétés différentes de cellules filles (c'est-à-dire qu'une cellule neuroépithéliale se divise en une cellule gliale radiale et une autre cellule neuroépithéliale), tandis que la version symétrique produit des cellules filles identiques. Cet effet est causé par l'orientation du fuseau mitotique, qui est situé dans la zone postérieure ou antérieure de la cellule mitotique, plutôt que le centre où il se trouve lors de la division symétrique. Les cellules progénitrices et les cellules gliales radiales répondent à des facteurs trophiques extracellulaires - comme le facteur neurotrophique ciliaire (CNTF), les cytokines ou la neuréguline 1 (NRG1) - qui peuvent déterminer si les cellules se différencieront en neurones ou en glies[5]. Dans l'ensemble, la neurogenèse est régulée à la fois par de nombreuses voies de régulation variées dans le SNC ainsi que par plusieurs autres facteurs, des gènes aux stimuli externes tels que le comportement individuel d'une personne. Le vaste réseau interconnecté de réponses régulatrices agit pour affiner les réponses fournies par les neurones nouvellement formés[6].
Neurogenèse dans la réparation neurale
La neurogenèse dans le cerveau adulte est souvent associée à des maladies qui détériorent le SNC, comme la maladie de Huntington, la maladie d'Alzheimer et la maladie de Parkinson . Chez les patients atteints de ces maladies, la neurogenèse dans l'hippocampe est plus haute. Sans qu'on sache si ces effets sont régénératifs ou non concluants[7]. Les personnes atteintes de ces maladies expriment également souvent des capacités olfactives diminuées ainsi qu'une activité cognitive diminuée dans l'hippocampe, des zones spécifiques à la neurogenèse. Les gènes associés à ces maladies comme l'alpha-synucléine, la préséniline 1, la protéine tau et la huntingtine sont également souvent associés à la plasticité du cerveau et à sa modification[8]. La neuroplasticité est associée à la neurogenèse de façon complémentaire. Les nouveaux neurones générés par les cellules neuroépithéliales, les progéniteurs et les cellules gliales radiales ne survivront que s'ils sont capables de s'intégrer dans le système en établissant des connexions avec de nouveaux voisins. Cela conduit également à de nombreux concepts controversés, comme la thérapie neurogène impliquant la greffe de cellules progénitrices locales dans une zone endommagée[7].
Maladies associées
Tumeur neuroépithéliale dysembryoplasique (TNT)
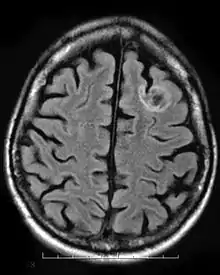
Une tumeur neuroépithéliale dysembryoplasique est une tumeur bénigne rare qui touche les enfants et les adolescents de moins de vingt ans. La tumeur se produit dans le tissu recouvrant le cerveau et la moelle épinière. Les symptômes de la tumeur dépendent de sa localisation, mais la plupart des enfants souffrent de crises qui ne peuvent être contrôlées par des médicaments. Elle est généralement traité par chirurgie invasive et les patients sont généralement capables de récupérer complètement, avec peu ou pas d'effets à long terme[9].
Kystes neuroépithéliaux
Les kystes neuroépithéliaux, également appelés kystes colloïdes, se développent chez les personnes âgées de 20 à 50 ans et sont relativement rares chez les personnes de moins de vingt ans. Les kystes sont des tumeurs bénignes qui apparaissent généralement dans le troisième ventricule antérieur. Les kystes se produisent dans l'épithélium, ce qui expose leurs patients à un risque d' hydrocéphalie obstructive, d'augmentation de la pression intracrânienne et, rarement, d'hémorragie intrakystique. Cela résulte de l'agrandissement des kystes en provoquant la sécrétion de liquide mucineux supplémentaire par l'épithélium. Les kystes sont généralement découverts fortuitement ou si les patients deviennent symptomatiques présentant les symptômes de l'hydrocéphalie. Les kystes les plus gros sont opérés tandis que les kystes plus petits qui ne sont pas obstructifs peuvent être laissés seuls[10].
Tumeurs oligodendrogliales
Les tumeurs oligodendrogliales se manifestent dans les cellules gliales, qui sont chargées de soutenir et de protéger les cellules nerveuses du cerveau. La tumeur se développe sur oligodendrocytes et se trouve généralement dans le cerveau autour des frontaux ou temporels lobes. Les tumeurs peuvent soit se développer lentement de manière bien différenciée, retardant l'apparition des symptômes, soit se développer rapidement pour former un oligodendrogliome anaplasique . Les symptômes de ce type de tumeur comprennent des maux de tête et des problèmes visuels. De plus, le blocage des ventricules pourrait provoquer une accumulation de liquide céphalo-rachidien entraînant un gonflement autour de la tumeur. L'emplacement de la tumeur peut également affecter les symptômes, car les tumeurs du lobe frontal peuvent provoquer des changements progressifs de l'humeur ou de la personnalité, tandis que les tumeurs du lobe temporal entraînent des problèmes de coordination et d'élocution[11].
Recherche en cours
Chimères neuronales
Les chercheurs ont pu créer des chimères neurales en combinant des neurones développés à partir de cellules souches embryonnaires avec des cellules gliales également dérivées de cellules souches embryonnaires . Ces chimères neuronales offrent aux chercheurs un moyen complet d'étudier les mécanismes moléculaires à l'origine de la réparation et de la régénération cellulaires via les cellules précurseurs neuroépithéliales et, espérons-le, feront la lumière sur une éventuelle réparation du système nerveux en milieu clinique. Dans une tentative d'identifier les caractéristiques clés qui différencient les cellules neuroépithéliales de leurs cellules progénitrices, les chercheurs ont identifié un filament intermédiaire qui était exprimé par 98% des cellules neuroépithéliales du tube neural, mais aucune de leurs cellules progénitrices. Après cette découverte, il est devenu clair que les trois types de cellules du système nerveux résultaient d'une population homogène de cellules souches. Afin de rendre possible la réparation neuronale clinique, les chercheurs devaient caractériser davantage la détermination régionale des cellules souches au cours du développement du cerveau en déterminant quels facteurs engagent un précurseur à devenir l'un ou l'autre. Bien que les facteurs exacts qui conduisent à la différenciation soient inconnus, les chercheurs ont profité des chimères neurales humain-rat pour explorer le développement des neurones humains et des cellules gliales dans un modèle animal. Ces chimères neuronales ont permis aux chercheurs d'étudier les maladies neurologiques dans un modèle animal où les changements traumatiques et réactifs peuvent être contrôlés. À terme, les chercheurs espèrent pouvoir utiliser les informations tirées de ces expériences de chimères neuronales pour réparer les régions du cerveau affectées par des troubles du système nerveux central. Le problème de la livraison, cependant, n'a toujours pas été résolu car il a été démontré que les chimères neurales circulent dans les ventricules et s'intègrent dans toutes les parties du SNC. En trouvant des indices environnementaux de différenciation, la transplantation de précurseurs neuroépithéliaux pourrait être utilisée dans le traitement de nombreuses maladies, notamment la sclérose en plaques, la maladie de Huntington et la maladie de Parkinson. Une exploration plus poussée des cellules chimères neurales et des cerveaux chimériques fournira des preuves pour manipuler les bons gènes et augmenter l'efficacité de la réparation des greffes neurales[12].
Dépression
Les recherches sur la dépression indiquent que l'un des principaux facteurs de causalité de la dépression, le stress, influence également la neurogenèse. Cette connexion a conduit les recherches à postuler que la dépression pourrait être le résultat de changements dans les niveaux de neurogenèse dans le cerveau adulte, en particulier dans le gyrus denté . Des études indiquent que le stress affecte la neurogenèse en augmentant les glucocorticoïdes et en diminuant les neurotransmetteurs tels que la sérotonine . Ces effets ont été en outre vérifiés en induisant un stress chez les animaux de laboratoire, ce qui a entraîné une diminution des niveaux de neurogenèse. De plus, les thérapies modernes qui traitent la dépression favorisent également la neurogenèse. Les recherches en cours cherchent à vérifier davantage cette connexion et à définir le mécanisme par lequel elle se produit. Cela pourrait potentiellement conduire à une meilleure compréhension du développement de la dépression ainsi que des futures méthodes de traitement[13].
Voir également
Références
- T Sadler, Langman's medical embryology., 11th., , 295–299 p. (ISBN 9780781790697)
- A. McDonald, Prenatal Development - The Dana Guide, The Dana Foundation, (ISBN 978-1-932594-10-2, lire en ligne)
- F. R. Zolessi, Encyclopedia of Life Sciences, (ISBN 978-0470016176, DOI 10.1002/9780470015902.a0000826.pub2), « Vertebrate Neurogenesis: Cell Polarity »
- Götz et Huttner, « The cell biology of neurogenesis », Nature Reviews Molecular Cell Biology, vol. 6, no 10, , p. 777–788 (PMID 16314867, DOI 10.1038/nrm1739)
- Clarke, « Neural stem cells », Bone Marrow Transplantation, vol. 32, , S13–S17 (PMID 12931233, DOI 10.1038/sj.bmt.1703937)
- Kempermann, « Seven principles in the regulation of adult neurogenesis », European Journal of Neuroscience, vol. 33, no 6, , p. 1018–1024 (PMID 21395844, DOI 10.1111/j.1460-9568.2011.07599.x)
- Taupin, « Adult neurogenesis, neuroinflammation and therapeutic potential of adult neural stem cells », International Journal of Medical Sciences, vol. 5, no 3, , p. 127–132 (PMID 18566676, PMCID 2424180, DOI 10.7150/ijms.5.127)
- Winner, Zacharias Kohl et Fred H. Gage, « Neurodegenerative disease and adult neurogenesis », European Journal of Neuroscience, vol. 33, no 6, , p. 1139–1151 (PMID 21395858, DOI 10.1111/j.1460-9568.2011.07613.x, lire en ligne, consulté le )
- « Dysembryoplastic Neuroepithelial Tumor » [archive du ], Children's Hospital Boston (consulté le )
- Chin et Jayarao, « Colloid Cysts », Medscape (consulté le )
- « Oligodendroglioma », Macmillan (consulté le )
- Brüstle, « Building brains: Neural chimeras in the study of nervous system development and repair », Brain Pathology, Zurich, Switzerland, vol. 9, no 3, , p. 527–545 (PMID 10416992, PMCID 8098370, DOI 10.1111/j.1750-3639.1999.tb00540.x)
- Jacobs, Praag et Gage, « Adult brain neurogenesis and psychiatry: a novel theory of depression », Molecular Psychiatry, vol. 5, no 3, , p. 262–269 (PMID 10889528, DOI 10.1038/sj.mp.4000712)