Acide pyroglutamique
L’acide pyroglutamique, également appelé 5-oxoproline et acide pidolique, est un acide aminé non standard présent dans certaines protéines par cyclisation d'un résidu d'acide glutamique donnant un lactame.
| Acide pyroglutamique | |
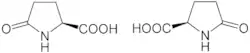 Acide L ou 2S(–)-pyroglutamique (à gauche). Acide D ou 2R(+)-pyroglutamique (à droite). |
|
| Identification | |
|---|---|
| Nom UICPA | acide (2S)-5-oxopyrrolidine-2-carboxylique |
| Synonymes |
5-oxo-L-proline, acide pidolique |
| No CAS | L ou S(–) D ou R(+) (racémique) |
| No ECHA | 100.021.578 |
| No CE | 202-700-3 L ou S(–) 223-735-0 D ou R(+) 205-748-3 (racémique) |
| PubChem | 7405 L ou S(–) 439685 D ou R(+) 499 (racémique) |
| ChEBI | 18183 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C5H7NO3 [Isomères] |
| Masse molaire[1] | 129,114 ± 0,005 6 g/mol C 46,51 %, H 5,46 %, N 10,85 %, O 37,18 %, |
| Propriétés physiques | |
| T° fusion | 162 à 163 °C |
| Précautions | |
| SGH[2] | |
 Attention |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Caractéristiques
Sa molécule est organisée autour d'un noyau pyrrolidine.
Il est soluble dans l'eau et dans le tert-butanol et très peu soluble dans la plupart des autres solvants organiques.
Présence
On le trouve notamment dans la bactériorhodopsine, et plus généralement chez les plantes.
Les résidus de glutamine N-terminaux peuvent également se cycliser spontanément en pyroglutamate.
Synthèse
De l'acide pyroglutamique peut être obtenu en chauffant simplement une solution à parts égales d'acide glutamique et d'eau à 135–140 °C.
L'acide domoïque a pu être synthétisé in vitro à partir d'acide pyroglutamique.
Les différents groupes fonctionnels de l'acide pyroglutamique permettent d'accéder à des structures complexes de type polycylique ou même à des alcaloïdes.
Comme synthon, il est d'autant plus intéressant qu'il possède un centre stéréogène qui permet de réaliser éventuellement des synthèses asymétriques.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.