Acide disulfurique
L’acide disulfurique, également appelé acide pyrosulfurique, est un composé chimique de formule H2S2O7. C'est un oxoacide sulfurique, en équilibre avec l'acide sulfurique (H2SO4) et l'eau (H2O) dans les solutions d'acide sulfurique anhydre, et avec l'acide sulfurique et le trioxyde de soufre (SO3) dans l'oléum :
| Acide disulfurique | |
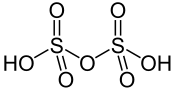  Structure de l'acide disulfurique |
|
| Identification | |
|---|---|
| Synonymes |
acide pyrosulfurique, oléum |
| No CAS | |
| No ECHA | 100.029.069 |
| No CE | 231-976-8 |
| PubChem | 62682 |
| ChEBI | 29211 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | H2O7S2 |
| Masse molaire[1] | 178,142 ± 0,012 g/mol H 1,13 %, O 62,87 %, S 36 %, |
| pKa | −3,1 |
| Propriétés physiques | |
| T° fusion | 35 °C |
| Masse volumique | 1,9 g·cm-3 |
| Précautions | |
| SGH[2] - [3] | |
Oléum :  Danger |
|
| Transport[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
ce second équilibre étant celui par lequel on réalise sa préparation.
L'acide disulfurique peut être vu comme l'analogue d'un anhydride d'acide pour l'acide sulfurique. Il est suffisamment fort pour protoner l'acide sulfurique anhydre. Il existe des sels d'acide disulfurique, tels que le pyrosulfate de potassium (K2S2O7).
Parmi les acides répondant à la formule générique H2O·(SO3)n, seuls les deux premiers termes ont pu être caractérisés jusqu'à présent : l'acide sulfurique, correspondant à n = 1, et l'acide disulfurique, pour n = 2 ; les termes correspondant à n ≥ 3 n'ont jamais été isolés.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- SIGMA-ALDRICH


