2-Éthylanthraquinone
La 2-éthylanthraquinone, un composé organique, est un dérivé éthylé de l'anthraquinone. Ce solide jaune pâle est utilisé dans la production industrielle de peroxyde d'hydrogène (H2O2)[2] - [3].
| 2-Éthylanthraquinone | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 2-éthylanthracène-9,10-dione | |
| No CAS | ||
| No ECHA | 100.001.396 | |
| No CE | 201-535-4 | |
| PubChem | 6772 | |
| SMILES | ||
| InChI | ||
| Apparence | Cristaux ou poudre blancs à jaunâtres. | |
| Propriétés chimiques | ||
| Formule | C16H12O2 [Isomères] |
|
| Masse molaire[1] | 236,265 3 ± 0,014 2 g/mol C 81,34 %, H 5,12 %, O 13,54 %, |
|
| Propriétés physiques | ||
| T° fusion | 105 °C | |
| T° ébullition | 415,4 °C | |
| Point d’éclair | 155,4 °C | |
| Précautions | ||
| SGH | ||
  |
||
| Unités du SI et CNTP, sauf indication contraire. | ||
Production
La 2-éthylanthraquinone est préparée à partir de la réaction de l'anhydride phtalique et l'éthylbenzène :
- C6H4(CO)2O + C6H5Et → C6H4(CO)2C6H3Et + H2O
L'anhydride phtalique et l'éthylbenzène sont facilement disponibles, et sont autrement utilisés dans la production à grande échelle de plastiques.
Usages
Le peroxyde d'hydrogène est produit industriellement par le procédé à l'anthraquinone qui implique l'utilisation de 2-alkyl-9,10-anthraquinones pour l'hydrogénation. De nombreux dérivés de l'anthraquinone sont utilisés mais la 2-éthylanthraquinone est courante en raison de sa haute sélectivité. L'hydrogénation du cycle non substitué peut atteindre une sélectivité de 90 % en utilisant de la 2-éthylanthraquinone. L'hydrogénation suit le processus de Riedl-Pfleiderer, ou auto-oxydation :
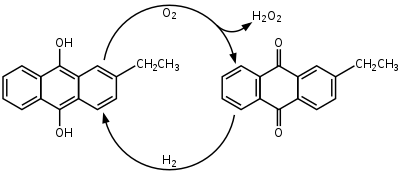
L'hydrogénation de la 2-éthylanthraquinone est catalysée par le palladium. L'hydrogénation produit à la fois de la 2-éthylanthrahydroquinone et de la tétrahydroanthraquinone. Le dérivé tétrahydro de la 2-alkylanthraquinone est facilement hydrogéné mais est plus difficile à oxyder. La formation du dérivé tétrahydro peut être supprimée par la sélection de catalyseurs, de solvants et des conditions de réaction. Certains mélanges de solvants suggérés sont des benzènes polyalkylés et des phosphates d'alkyle ou des tétraalkylurées, des triméthylbenzènes et des esters d'alkylcyclohexanol, et des alcools méthylnaphtalène et nonyl.
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Goor, G. ; Glenneberg, J. et Jacobi, S. (2007), Hydrogen Peroxide, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, DOI 10.1002/14356007.a13_443.pub2.
- Römpp CD 2006, Georg Thieme Verlag, 2006.