Vinylogie
En chimie organique, la vinylogie est la transmission, à travers un système conjugué de liaisons π, des effets électroniques entre deux groupes d'atomes en résonance[1]. Ce concept a été introduit en 1926 par Ludwig Claisen pour expliquer les propriétés acides de la formylacétone CH3COCH2CHO et des cétoaldéhydes apparentés[2]. L'adjectif vinylogue se réfère à des groupes fonctionnels dans lesquels les groupes d'atomes sont séparés par une double liaison C=C ; par exemple, un composé organique ayant une double liaison C=C (correspondant à un groupe vinylène –CH=CH–) situé entre un groupe carbonyle C=O et un groupe hydroxyle –OH est appelé acide carboxylique vinylogue –C(=O)CH=CHOH.
La transmission des effets électroniques à travers la conjugaison confère à ces groupes fonctionnels vinylogues des propriétés chimiques et une réactivité « analogues » à celles du groupe fonctionnel parent. La vinylogie offre par conséquent un moyen de prédire le comportement de systèmes structurellement semblables mais contenant des doubles liaisons C=C conjuguées avec les groupes fonctionnels liés. Par exemple, l'une des propriétés essentielles des acides carbonxyliques est leur acidité de Brønsted. Le plus simple d'entre eux, l'acide formique HCOOH est un acide faible, avec un pKa de 3,7. L'acide carboxylique vinylogue correspondant, le 2-formyl-1-éthén-1-ol HC(=O)CH=CHOH est également un acide de Brønsted, dont le pKa est de l'ordre de 5 à 6. Les acides carboxyliques vinylogues sont notamment des acides sensiblement plus forts que les énols typiques, dont le pKa est de l'ordre de 12. L'acide ascorbique (vitamine C) est un exemple biologiquement important d'acide carboxylique vinylogue.
L'insertion d'un cycle o- ou p-phénylène peut également conduire à une réactivité similaire, bien que l'effet soit généralement plus faible en raison du fait que la conjugaison à travers le cycle aryle induit des formes de résonance qui rompent l'aromaticité[3] - [4].
Réactions vinylogues
Les réactions vinylogues s'expliqueraient par l'alignement et la superposition des orbitales des doubles liaisons des groupes vinyle avec celles d'un groupe électroattracteur, ce qui rendrait possible leur conjugaison. La délocalisation des électrons permet au groupe électroattracteur d'accroître la densité électronique à son niveau en participant au système conjugué. L'addition nucléophile conjuguée est également une réaction vinylogue, au cours de laquelle un nucléophile réagit à l'extrémité vinylique, et est une variante vinylogue de l'aldolisation, au cours de laquelle un électrophile est attaqué par un énolate nucléophile vinylogue. Ce dernier réagit sur le carbone γ à l'extrémité du système de doubles liaisons plutôt que sur le carbone α adjacent au carbonyle, contrairement à un énolate. Les électrophiles allyliques réagissent souvent par attaque vinylogue d'un nucléophile plutôt que par addition directe.
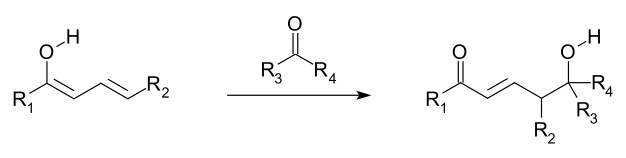 Aldolisation vinylogue.
Aldolisation vinylogue.
L'acide ascorbique (vitamine C) se comporte comme un acide carboxylique vinylogue à travers son groupe carbonyle, son groupe vinyle dans le cycle, et le doublet non liant sur le groupe hydroxyle, l'ensemble formant un système conjugué. L'acidité du proton de l'hydroxyle à l'extrémité du groupe vinyle s'apparent davantage à celle d'un carboxyle qu'à celle d'un alcool car deux formes de résonance stabilisent la charge négative sur la base conjuguée de l'acide ascorbique.
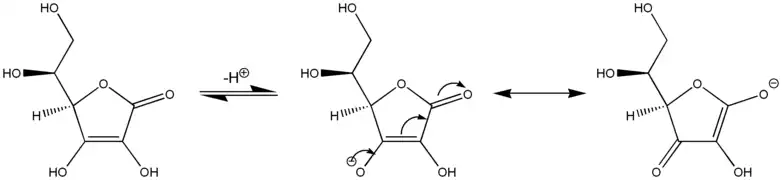 Formes de résonance de l'acide ascorbique (à gauche) stabilisant la charge négative sur sa base conjuguée (au centre et à droite).
Formes de résonance de l'acide ascorbique (à gauche) stabilisant la charge négative sur sa base conjuguée (au centre et à droite).
Notes et références
- (en) Giovanni Casiraghi, Franca Zanardi, Giovanni Appendino et Gloria Rassu, « The Vinylogous Aldol Reaction: A Valuable, Yet Understated Carbon−Carbon Bond-Forming Maneuver », Chemical Reviews, vol. 100, no 6, , p. 1929-1972 (PMID 11749280, DOI 10.1021/cr990247i, lire en ligne)
- (de) Ludwig Claisen, « Zu den O‐Alkylderivaten des Benzoyl‐acetons und den aus ihnen entstehenden Isoxazolen. (Entgegnung an Hrn. O. Weygand.) », Berichte der deutschen chemischen Gesellschaft (A and B Series), vol. 59, no 2, , p. 144-153 (DOI 10.1002/cber.19260590206, lire en ligne)
- (en) Ryu Yamasakia, Hirokazu Ikeda, Hyuma Masu, Isao Azumaya et Shinichi Saito, « Synthesis and properties of phenylogous amides », Tetrahedron, vol. 68, no 40, , p. 8450-8456 (DOI 10.1016/j.tet.2012.07.084, lire en ligne)
- (en) Anthony J. Lawrence, Michael G. Hutchings, Alan R. Kennedy et Joseph J. W. McDouall, « Benzodifurantrione: A Stable Phenylogous Enol », The Journal of Organic Chemistry, vol. 75, no 3, , p. 690-701 (PMID 20055373, DOI 10.1021/jo9022155, lire en ligne)