Tyrosine kinase de Bruton
La tyrosine kinase de Bruton (Btk ou BTK) est une tyrosine kinase qui est codée par le gène BTK chez l'humain. Elle joue un rôle crucial dans le développement des lymphocytes B.
| Tyrosine kinase de Bruton | ||
 Tyrosine kinase de Bruton | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | Btk | |
| Homo sapiens | ||
| Locus | Xq22.1 | |
| Entrez | 695 | |
| HUGO | 1133 | |
| OMIM | 300300 | |
| UniProt | Q06187 | |
| RefSeq (ARNm) | NM_001287345, NM_000061, NM_001287344 | |
| RefSeq (protéine) | NP_000052, NP_001274273, NP_001274274 | |
| Ensembl | ENSG00000010671 | |
|
GENATLAS • GeneTests • GoPubmed • HCOP • H-InvDB • Treefam • Vega | ||
| Liens accessibles depuis GeneCards et HUGO. | ||
Structure
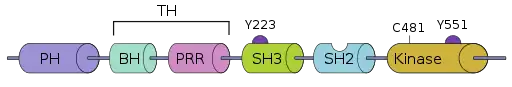
La tyrosine kinase de Bruton contient cinq domaines d'interaction protéique différents. Ces domaines comprennent un domaine aminoterminal d'homologie de pleckstrine (PH), un domaine d'homologie TEC riche en proline (TH), les domaines d'homologie SRC (SH) SH2 et SH3, ainsi qu'un domaine kinase avec une activité enzymatique[1].
Fonction
La BTK joue un rôle crucial dans le développement des lymphocytes B car elle est nécessaire pour transmettre les signaux du récepteur des cellules pré-B qui se forment après un réarrangement réussi des chaines lourdes d'immunoglobulines[2]. Il a également un rôle dans l'activation des mastocytes par le biais du récepteur IgE de haute affinité[3].
La Btk contient un domaine PH qui se lie au phosphatidylinositol-3,4,5-trisphosphate (PIP3). La liaison au PIP3 conduit la Btk à phosphoryler la phospholipase C, qui à son tour hydrolyse le PIP2, un phosphatidylinositol, en deux seconds messagers, l'inositol triphosphate (IP3) et le diacylglycérol (DAG), qui continuent ensuite à moduler l'activité des protéines en aval lors de la signalisation des lymphocytes B.
Clinique
Les mutations du gène BTK sont impliquées dans la maladie d'immunodéficience primaire qu'est la agammaglobulinémie liée au sexe (agammaglobulinémie de Bruton), parfois abrégée en XLA ou en déficit sélectif en IgM[4]. Les patients atteints de XLA ont des populations normales de cellules pré-B dans leur moelle osseuse, mais ces cellules ne parviennent pas à maturité et à entrer dans la circulation. Le gène Btk est situé sur le chromosome X (Xq21.3-q22)[5]. Au moins 400 mutations du gène BTK ont été identifiées.
Inhibiteurs de la BTK
Médicaments approuvés qui inhibent la BTK :
- Ibrutinib (PCI-32765), un inhibiteur sélectif de la tyrosine kinase de Bruton ;
- Acalabrutinib, approuvé en pour le lymphome à cellules du manteau en rechute[6] ;
- Zanubrutinib pour le lymphome à cellules du manteau[7] ; il peut être administré par voie orale[8].
Plusieurs inhibeurs de la BTK sont en cours d'essais cliniques[9] :
- Phase 3 :
- Acalabrutinib, pour la rechute de la leucémie lymphoïde chronique (LLC), avec 95 % de rémission globale ;
- Phase 2 :
- Evobrutinib pour la sclérose en plaques[10] - [11] ;
- ABBV-105 pour le lupus érythémateux disséminé (LED)[12] ;
- Phase 1 :
- ONO-4059 pour les lymphomes non hodgkinien réfractaires ou la LLC[13]. Renommé GS-4059, il intègre l'essai NCT02457598[14] ;
- Spebrutinib (AVL-292, CC-292)[15] ;
- HM71224 pour les maladies auto-immunes, en développement depuis 2015 par Hanmi Pharmaceutical et Lilly[16].
Découverte
La tyrosine kinase de Bruton a été découverte en 1993 et porte le nom d'Ogden Bruton, qui a décrit la XLA pour la première fois en 1952[5].
Interactions
La tyrosine kinase de Bruton interagit avec les protéines suivantes :
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Bruton's tyrosine kinase » (voir la liste des auteurs).
- Pal Singh S, Dammeijer F, Hendriks RW, « Role of Bruton's tyrosine kinase in B cells and malignancies », Molecular Cancer, vol. 17, no 1, , p. 57 (PMID 29455639, DOI 10.1186/s12943-018-0779-z
 )
) - Judith A. Owen, Jenni Punt, Sharon A. Stranford et Patricia P. Jones, Kuby Immunology, New York, W.H. Freeman, , 7e éd., 574 p. (ISBN 978-1-4641-3784-6), p. 93
- Helen Turner et Jean-Pierre Kinet, « Signalling through the high-affinity IgE receptor FcεRI », Nature, vol. 402, no S6760, , p. 24–30 (PMID 10586892)
- Geier Christoph, « Hypomorphic Mutations in the BCR Signalosome Lead to Selective Immunoglobulin M Deficiency and Impaired B-cell Homeostasis », Frontiers in Immunology, (PMID 30619340, lire en ligne)
- X-Linked Agammaglobulinemia Patient and Family Handbook for The Primary Immune Diseases. Third Edition. 2001. Published by the Immune Deficiency Foundation.
- https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm583076.htm
- « FDA approves therapy to treat patients with relapsed and refractory mantle cell lymphoma supported by clinical trial results showing high response rate of tumor shrinkage », sur U.S. Food and Drug Administration (FDA), (consulté le )
- BeiGene Announces Initiation of a Combination Trial of the BTK Inhibitor BGB-3111 with the PD-1 Antibody BGB-A317. June 2016
- Astra Signals A Late Run On BTK Inhibition. Dec 2015
- Montalban X, Arnold DL, Weber MS, Staikov I, Piasecka-Stryczynska K, Willmer J, Martin EC, Dangond F, Syed S, Wolinsky JS, « Placebo-Controlled Trial of an Oral BTK Inhibitor in Multiple Sclerosis », N. Engl. J. Med., vol. 380, no 25, , p. 2406–2417 (PMID 31075187, DOI 10.1056/NEJMoa1901981
 )
) - « A Study of Efficacy and Safety of M2951 in Subjects With Relapsing Multiple Sclerosis », sur ClinicalTrials.gov, (consulté le )
- « A Study to Investigate the Safety and Efficacy of ABBV-105 and Upadacitinib Given Alone or in Combination in Participants With Moderately to Severely Active Systemic Lupus Erythematosus - Full Text View - ClinicalTrials.gov », sur clinicaltrials.gov (consulté le )
- (en) Essai clinique NCT01659255 intitulé « ONO-4059 Phase I Dose-escalation Study to Investigate the Safety and Tolerability of ONO-4059 Given as Monotherapy in Patients With Relapsed/Refractory Non-Hodgkin's Lymphoma and/or Chronic Lymphocytic Leukaemi » sur ClinicalTrials.gov.
- « Novel BTK, PI3K Inhibitors on Horizon for Relapsed CLL. March 2016 » [archive du ] (consulté le )
- (en) Essai clinique NCT01351935 intitulé « Escalating Dose Study in Subjects With Relapsed or Refractory B Cell Non-Hodgkin Lymphoma, Chronic Lymphocytic Leukemia, and Waldenstrom's Macroglobulinemia » sur ClinicalTrials.gov.
- (en) Damian Garde, « Lilly inks a $690M deal to get its hands on an autoimmune drug », FierceBiotech, (lire en ligne)
- Nixon JC, Rajaiya JB, Ayers N, Evetts S, Webb CF, « The transcription factor, Bright, is not expressed in all human B lymphocyte subpopulations », Cell. Immunol., vol. 228, no 1, , p. 42–53 (PMID 15203319, DOI 10.1016/j.cellimm.2004.03.004)
- Yasuda T, Tezuka T, Maeda A, Inazu T, Yamanashi Y, Gu H, Kurosaki T, Yamamoto T, « Cbl-b positively regulates Btk-mediated activation of phospholipase C-gamma2 in B cells », J. Exp. Med., vol. 196, no 1, , p. 51–63 (PMID 12093870, PMCID 2194016, DOI 10.1084/jem.20020068)
- Hashimoto S, Iwamatsu A, Ishiai M, Okawa K, Yamadori T, Matsushita M, Baba Y, Kishimoto T, Kurosaki T, Tsukada S, « Identification of the SH2 domain binding protein of Bruton's tyrosine kinase as BLNK--functional significance of Btk-SH2 domain in B-cell antigen receptor-coupled calcium signaling », Blood, vol. 94, no 7, , p. 2357–64 (PMID 10498607, DOI 10.1182/blood.V94.7.2357.419k40_2357_2364)
- Vargas L, Nore BF, Berglof A, Heinonen JE, Mattsson PT, Smith CI, Mohamed AJ, « Functional interaction of caveolin-1 with Bruton's tyrosine kinase and Bmx », J. Biol. Chem., vol. 277, no 11, , p. 9351–7 (PMID 11751885, DOI 10.1074/jbc.M108537200
 )
) - Ma YC, Huang XY, « Identification of the binding site for Gqalpha on its effector Bruton's tyrosine kinase », Proc. Natl. Acad. Sci. U.S.A., vol. 95, no 21, , p. 12197–201 (PMID 9770463, PMCID 22808, DOI 10.1073/pnas.95.21.12197)
- Sacristán C, Tussié-Luna MI, Logan SM, Roy AL, « Mechanism of Bruton's tyrosine kinase-mediated recruitment and regulation of TFII-I », J. Biol. Chem., vol. 279, no 8, , p. 7147–58 (PMID 14623887, DOI 10.1074/jbc.M303724200
 )
) - Novina CD, Kumar S, Bajpai U, Cheriyath V, Zhang K, Pillai S, Wortis HH, Roy AL, « Regulation of nuclear localization and transcriptional activity of TFII-I by Bruton's tyrosine kinase », Mol. Cell. Biol., vol. 19, no 7, , p. 5014–24 (PMID 10373551, PMCID 84330, DOI 10.1128/mcb.19.7.5014)
- Yang W, Desiderio S, « BAP-135, a target for Bruton's tyrosine kinase in response to B cell receptor engagement », Proc. Natl. Acad. Sci. U.S.A., vol. 94, no 2, , p. 604–9 (PMID 9012831, PMCID 19560, DOI 10.1073/pnas.94.2.604)
- Guo B, Kato RM, Garcia-Lloret M, Wahl MI, Rawlings DJ, « Engagement of the human pre-B cell receptor generates a lipid raft-dependent calcium signaling complex », Immunity, vol. 13, no 2, , p. 243–53 (PMID 10981967, DOI 10.1016/s1074-7613(00)00024-8)
- Johannes FJ, Hausser A, Storz P, Truckenmüller L, Link G, Kawakami T, Pfizenmaier K, « Bruton's tyrosine kinase (Btk) associates with protein kinase C mu », FEBS Lett., vol. 461, nos 1–2, , p. 68–72 (PMID 10561498, DOI 10.1016/S0014-5793(99)01424-6)
- Matsushita M, Yamadori T, Kato S, Takemoto Y, Inazawa J, Baba Y, Hashimoto S, Sekine S, Arai S, Kunikata T, Kurimoto M, Kishimoto T, Tsukada S, « Identification and characterization of a novel SH3-domain binding protein, Sab, which preferentially associates with Bruton's tyrosine kinase (BtK) », Biochem. Biophys. Res. Commun., vol. 245, no 2, , p. 337–43 (PMID 9571151, DOI 10.1006/bbrc.1998.8420)
- Yamadori T, Baba Y, Matsushita M, Hashimoto S, Kurosaki M, Kurosaki T, Kishimoto T, Tsukada S, « Bruton's tyrosine kinase activity is negatively regulated by Sab, the Btk-SH3 domain-binding protein », Proc. Natl. Acad. Sci. U.S.A., vol. 96, no 11, , p. 6341–6 (PMID 10339589, PMCID 26883, DOI 10.1073/pnas.96.11.6341)
Voir aussi
Bibliographie
- Ochs HD, Aruffo A, « Advances in X-linked immunodeficiency diseases », Curr. Opin. Pediatr., vol. 5, no 6, , p. 684–91 (PMID 7907259, DOI 10.1097/00008480-199312000-00008)
- Uckun FM, « Bruton's tyrosine kinase (BTK) as a dual-function regulator of apoptosis », Biochem. Pharmacol., vol. 56, no 6, , p. 683–91 (PMID 9751072, DOI 10.1016/S0006-2952(98)00122-1)
- Tsubata T, Wienands J, « B cell signaling. Introduction », Int. Rev. Immunol., vol. 20, no 6, , p. 675–8 (PMID 11913944, DOI 10.3109/08830180109045584)
- Etzioni A, « Novel aspects of hypogammaglobulinemic states », Isr. Med. Assoc. J., vol. 4, no 4, , p. 294–7 (PMID 12001708)
- Niiro H, Clark EA, « Branches of the B cell antigen receptor pathway are directed by protein conduits Bam32 and Carma1 », Immunity, vol. 19, no 5, , p. 637–40 (PMID 14614850, DOI 10.1016/S1074-7613(03)00303-0)
- Carpenter CL, « Btk-dependent regulation of phosphoinositide synthesis », Biochem. Soc. Trans., vol. 32, no Pt 2, , p. 326–9 (PMID 15046600, DOI 10.1042/BST0320326, lire en ligne)
- Hendriks RW, Kersseboom R, « Involvement of SLP-65 and Btk in tumor suppression and malignant transformation of pre-B cells », Semin. Immunol., vol. 18, no 1, , p. 67–76 (PMID 16300960, DOI 10.1016/j.smim.2005.10.002)
Articles connexes
- Ibrutinib (PCI-32765)